
【题目】次氯酸溶液是常用的消毒剂和漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。(装置及实验)用以下装置制备次氯酸溶液。
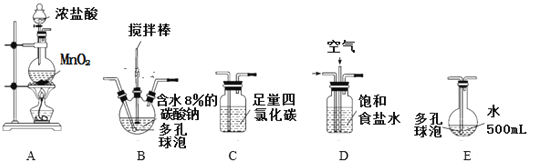
回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)反应过程中,装置B需放在冷水中,其目的是_________________________。
(3)装置C的主要作用是______________________。
(4)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为_________g。
(5)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定E中次氯酸溶液的物质的量浓度的实验方案为:用________________准确量取20.00 mL次氯酸溶液,加入足量的________溶液,再加入足量的________溶液,过滤,洗涤,真空干燥,称量沉淀的质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。)
【答案】A D B C 防止反应放热后温度过高导致Cl2O分解 除去Cl2O中的Cl2 57.6 酸式滴定管 H2O2 溶液 AgNO3溶液
【解析】
(1)各装置的作用为:A制取氯气,B制取Cl2O,C除去Cl2O中的Cl2,D除去Cl2中的HCl,E制HClO。由此可确定各装置的连接顺序。
(2)题中信息,Cl2O沸点为3.8℃,42 ℃以上会分解,所以反应过程中,装置B需放在冷水中。
(3)上面已分析出装置C的主要作用。
(4)n(HClO)= 0.8mol/L×0.5L=0.4mol,n(Cl2O)=0.2mol,则生成的Cl2O的物质的量为![]() =0.25mol,由方程式2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,可求出参加反应的n(Na2CO3)=0.5mol,由此可求出至少需要含水8%的碳酸钠的质量。
=0.25mol,由方程式2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,可求出参加反应的n(Na2CO3)=0.5mol,由此可求出至少需要含水8%的碳酸钠的质量。
(5)准确量取20.00 mL次氯酸溶液,需要达到小数点后两位的精度,应使用滴定管,次氯酸具有强氧化性,会腐蚀橡胶,所以需使用酸式滴定管。测定E中次氯酸溶液的浓度时,若使用FeCl2溶液,则依据现有的药品,无法达到目的,所以应使用H2O2溶液和AgNO3溶液。
(1)各装置的作用为:A制取氯气,B制取Cl2O,C除去Cl2O中的Cl2,D除去Cl2中的HCl,E制HClO。各装置的连接顺序为A→D→B→C→E。答案为:A;D;B;C;
(2)反应过程中,装置B需放在冷水中,其目的是防止反应放热后温度过高导致Cl2O分解。答案为:防止反应放热后温度过高导致Cl2O分解;
(3)装置C的主要作用是除去Cl2O中的Cl2。答案为:除去Cl2O中的Cl2;
(4)n(HClO)= 0.8mol/L×0.5L=0.4mol,n(Cl2O)=0.2mol,则生成的Cl2O的物质的量为![]() =0.25mol,由方程式2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,可求出参加反应的n(Na2CO3)=0.5mol,至少需要含水8%的碳酸钠的质量为
=0.25mol,由方程式2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,可求出参加反应的n(Na2CO3)=0.5mol,至少需要含水8%的碳酸钠的质量为![]() =57.6g。答案为:57.6;
=57.6g。答案为:57.6;
(5)准确量取20.00 mL次氯酸溶液,需要达到小数点后两位的精度,是量筒所不能做到的,所以应使用滴定管,但次氯酸具有强氧化性,会腐蚀橡胶。测定E中次氯酸溶液的浓度时,加入足量的H2O2溶液,再加入足量的AgNO3溶液,过滤,洗涤,真空干燥,称量沉淀的质量。若使用FeCl2溶液,则依据现有的药品,无法达到目的,所以应使用和溶液。答案为:酸式滴定管;H2O2 溶液;AgNO3溶液。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
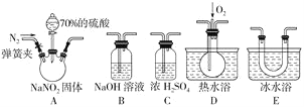
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下三种途径来制取相同质量的硝酸铜
①铜与浓硝酸反应 ②铜与稀硝酸反应 ③铜先跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述中正确的是
A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量是:途径①>途径②>途径③
D.所消耗的硝酸的物质的量是:途径①>途径③>途径②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列书写正确的是( )
A.在酸性碘化钾溶液中滴加双氧水:2I-+2H++H2O2===I2+2H2O
B.向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-===BaSO4↓+H2O
C.氢硫酸电离:H2S![]() 2H+ + S2-
2H+ + S2-
D.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+===SO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】满足下列条件的有机物的种类数正确的是
选项 | 有机物 | 条件 | 种类数 |
A | C5H10O2 | 在酸性条件下会水解生成甲和乙,且甲、乙的相对分子质量相等 | 4 |
B | C6H12O2 | 能与 NaHCO3溶液反应 | 3 |
C | C5H12O | 含有2个甲基的醇 | 5 |
D |
| 该有机物的一氯代物 | 4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.加铁氰化钾产生蓝色沉淀的溶液中:Na+、Al3+、SO42-、ClO-
B.0.1mol/L的烧碱溶液中:K+、Ba2+、Cl-、HCO3-
C.![]() =1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两气体A、B分别为0.6mo1与0.5mo1,在0.4L密闭容器中发生反应:3A+BmC+2D(C、D均为气态物质),经5min后达到平衡,此时C为0.2mo1,在此时间内D的平均反应速率为0.1mo1L-1min-1,下列结论错误的是( )
A.平衡时反应混合物总物质的量为1mo1
B.B的转化率为20%
C.A的平均反应速率为0.15mo1L-1min-1
D.m值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作I:在试管中加入5mL 1mol/L NaOH水溶液和5mL溴乙烷,将试管按如图固定后,加热。
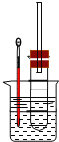
(1)请写出该反应的化学方程式_______。
(2)观察到_____现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)欲将生成的有机物从反应混合物中进行分离出来,最简单的操作是____(填操作名称)。
(4)请述如何检验溴乙烷中含有溴元素___________
实验操作Ⅱ:在试管中加入5 mL NaOH的乙醇溶液和5mL溴乙烷,将试管如图固定后,加热。
(5)请写出该反应的化学方程式_______。
(6)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是_______(写化学式),检验的方法是_________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)1735年瑞典化学家布兰特(G·Brands)制出金属钴。钴的矿物或钴的化合物一直用作陶瓷、玻璃、珐琅的釉料。到20世纪,钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属。所以钴及其化合物具有重要作用,回答下列问题:
(1)基态Co原子的电子排布式为___________。
(2)[Co(NH3)5H2O]Cl3是一种砖红色的晶体,可通过CoCl2、NH4Cl、浓氨水、H2O2制得。
①Co、N、0原子的第一电离能由大到小的顺序是__________。
②[Co(NH3)5H2O]Cl3中Co元素化合价为____,其配位原子为_____;1mol该晶体中含有____molσ键。
③H2O2中O原子的杂化轨道类型是______,H2O2能与水互溶,除都是极性分子外,还因为____。
④NH3、NF3的空间构型都相同,但Co3+易与NH3形成配离子,而NF3不能。原因是________。
(3)CoO晶胞如图,已知Co原子半径为apm,O原子半径为bpm,则等距最近的所有O原子围成的空间形状为_____;该晶胞中原子的空间利用率为__________(用含a、b的计算式表示)。
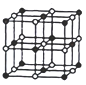
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com