
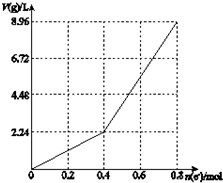
| A�� | ���ǰCuSO4��Һ�����ʵ���Ũ��Ϊ2 mol/L | |
| B�� | ����������Һ��c��H+��=2 mol/L | |
| C�� | ��n��e-��=0.6 molʱ��V��H2����V��O2��=3��2 | |
| D�� | ��������Һ���Ⱥ����16 g CuO��3.6gˮ������Һ�ɻָ�Ϊ���ǰ��Ũ�� |
���� ���CuSO4��Һʱ����ʼ������Ӧ��2CuSO4+2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2��+2H2SO4��һ��ʱ���ת����ͬ����ʱ�õ������������˵��������Ӧ��2H2O$\frac{\underline{\;���\;}}{\;}$2H2��+O2����
A����ת��0.4mol����ʱCu2+��ȫ���������ݵ���ת���غ����n��Cu2+��������Cuԭ���غ��c��CuSO4��=c��Cu2+��=$\frac{n}{V}$��
B����ת��0.4mol����ʱ������n��H2SO4��=0.2mol��������Һ���С��200mL��
C����ת��0.4mol����ʱ���ɵ�������ȫ����������ת�Ƶ���0.4mol-0.6mol֮��ʱ���ɵ����������������������ݵ���ת���غ�����������������ʵ�����
D����ʼ�����൱������CuO���ڶ����̵��ˮ��Ҫʹ�������Һ�ָ�ԭ״Ӧ����CuO��ˮ����ϵ���ת���غ���㣮
��� �⣺���CuSO4��Һʱ����ʼ������Ӧ��2CuSO4+2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2��+2H2SO4��һ��ʱ���ת����ͬ����ʱ�õ������������˵��������Ӧ��2H2O$\frac{\underline{\;���\;}}{\;}$2H2��+O2����
A����ת��0.4mol����ʱCu2+��ȫ���������ݵ���ת���غ�n��Cu2+��=$\frac{0.4mol}{2}$=0.2mol������Cuԭ���غ㣬���ǰc��CuSO4��=c��Cu2+��=$\frac{0.2mol}{0.2L}$=1mol/L����A����
B����ת��0.4mol����ʱ������n��H2SO4��=0.2mol��������Һ���С��200mL���ʵ���������Һ��c��H+������2 mol/L����B����
C����ת��0.4mol����ʱ���ɵ�������ȫ����������ת�Ƶ���0.4mol-0.6mol֮��ʱ���ɵ����������������������ݵ���ת���غ㣬��ʼ��������Ϊ$\frac{0.6mol}{4}$=0.15mol����������Ϊ$\frac{0.6mol-0.4mol}{2}$=0.1mol����V��H2����V��O2��=0.1mol��0.15mol=2��3����C����
D����ʼ�����൱������CuO���ڶ����̵��ˮ��CuOΪ0.2mol��������Ϊ0.2mol��80g/mol=16g�����ݵ���ת���غ㣬�ڶ����̵���ˮΪ$\frac{0.8mol-0.4mol}{2}$=0.2mol��ˮ������Ϊ0.2mol��18g/mol=3.6g������������Һ���Ⱥ����16 g CuO��3.6gˮ����Һ�ɻָ�Ϊ���ǰ��Ũ�ȣ���D��ȷ��
��ѡ��D��
���� ���⿼����ԭ�����йؼ��㣬��ȷ���ӷŵ�˳�������з����ķ�Ӧ�ǽⱾ��ؼ���ע��ת�Ƶ����غ��������ã���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ŵ�ʱ������6mol���ӷ���ת�ƣ�����2mol K2FeO4������ | |
| B�� | �ŵ�ʱ��������ӦΪ��FeO42-+4H2O+3e-�TFe��OH��3+5OH- | |
| C�� | ���ʱ����صĸ�������ӵ�Դ���������� | |
| D�� | ���ʱ������������Һ��pH��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϩ����ϩ�������ƣ����ܷ����ӳɷ�Ӧ | |
| B�� | ��ά�ء����ά�������л��߷��ӻ����� | |
| C�� | ��ϩ���Ҵ����ɷ����ӳɷ�Ӧ | |
| D�� | ������CH4��Cl2�ڹ����·�Ӧ�������ɴ�����CH3Cl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �»���2009��10��15�ձ�����ȫ��ũ��Ӧ���ڡ���ɫ��̬-�������-��̼����-ѭ����չ�������������£����ø���ط�չ���й���ɫ��ׯ�������롰��̫���ʵ�̼ũׯ�����裮�ɼ�����̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺
�»���2009��10��15�ձ�����ȫ��ũ��Ӧ���ڡ���ɫ��̬-�������-��̼����-ѭ����չ�������������£����ø���ط�չ���й���ɫ��ׯ�������롰��̫���ʵ�̼ũׯ�����裮�ɼ�����̼ѭ�����Ѿ������˹�������ӣ��Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ۡ���ά�غ͵����ʾ����ڸ߷��ӻ����� | |
| B�� | ��Ư��Ư��ʱ����ˮ��Һ�мӼ��ΰ״ף�����ǿƯ��Ч�� | |
| C�� | �����Ҵ��Ļ�ԭ���Լ�Cr3+��Cr2O7-����ɫ����������ƺ�ݳ� | |
| D�� | �ϳ���ά���ά�����������ǽ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ����ˮ��ȡ��ҵ�ƾ� | |
| B�� | �ƾ���Ũ�����Ϻ���������ȡ��ϩ | |
| C�� | ����������ڹ�����������ȡ�ȷ� | |
| D�� | ��ʯ�Һʹ����ƾ�����ȡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����¶� | B�� | ʹ�ô��� | C�� | ����H2Ũ�� | D�� | ��Сѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com