
| A. | 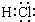 | B. | 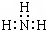 | C. | 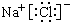 | D. |  |
分析 A.HCl为共价化合物,分子中存在1对共用电子对,氯原子最外层一个为8个电子.
B.NH3为共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子;
C.NaCl为离子化合物,电子式中需要标出阴阳离子所带电荷;
D.NaOH为离子化合物,含离子键和O-H共价键,由钠离子和氢氧根离子构成.
解答 解:A.HCl为共价化合物,分子中存在1对共用电子对,氯原子最外层一个为8个电子,电子式为 ,故A正确;
,故A正确;
B.NH3为共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子,电子式为 ,故B错误;
,故B错误;
C.NaCl为离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,电子式为 ,故C正确;
,故C正确;
D.NaOH为离子化合物,含离子键和O-H共价键,由钠离子和氢氧根离子构成,其电子式为 ,故D正确;
,故D正确;
故选B.
点评 本题考查了电子式的判断,该题基础性强,难易适中,注意掌握电子式的概念及正确的表示方法.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
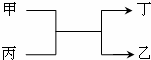 甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )
甲、乙为短周期同一主族元素的单质,丙、丁为氧化物,它们存在如图转化关系,下列各组的甲和乙一定符合的是( )| A. | 钠和氢 | B. | 氧和硫 | C. | 碳和硅 | D. | 氟和氯 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 47 | B. | 175 | C. | 61 | D. | 57 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
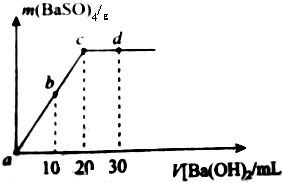 室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )
室温下,向20m1,物质的量浓度为0.35mol/L的H2SO4溶液中逐滴加人浓度的Ba(OH)2溶液,生成的沉淀与加人Ba(OH)2的体积如图(混合后体积变化忽略不计)下列说法不正确的是( )| A. | Ba(OH)2的物质的量浓密度为0.35mol/L | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.175mol/L | |
| C. | c时刻溶液显中性 | |
| D. | 实验过程中a、b、c三处溶液的导电能力c<b<a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com