
科目:高中化学 来源: 题型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |

查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省佛山市高三教学质量检测(二)理综化学试卷(解析版) 题型:计算题
以下是一些物质的熔沸点数据(常压):
|
|
钾 |
钠 |
Na2CO3 |
金刚石 |
石墨 |
|
熔点(℃) |
63.65 |
97.8 |
851 |
3550 |
3850 |
|
沸点(℃) |
774 |
882.9 |
1850(分解产生CO2) |
---- |
4250 |
金属钠和CO2在常压、890℃发生如下反应:
4 Na(g)+ 3CO2(g) 2
Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
2
Na2CO3(l)+ C(s,金刚石) △H=-1080.9kJ/mol
(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1680℃,若反应时间为10min, 金属钠的物质的量减少了0.20mol,则10min里CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由是 。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式 。
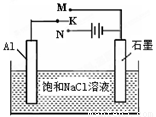
(5)下图开关K接M时,石墨作 极,电极反应式为 。K接N一段时间后测得有0.3mol电子转移,作出y随x变化的图象〖x—代表n(H2O)消耗,y—代表n[Al(OH)3],反应物足量,标明有关数据〗

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com