
【题目】正丁醇常用作有机反应的溶剂。实验室制备正丁醚的主要实验装置如图:
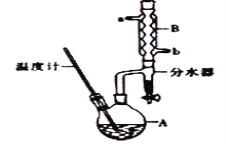
反应物和产物的相关数据如表:
相对分子质量 | 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成正丁醚的步骤:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间,分离提纯;
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40mL水、20mLNaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚13g。
请回答:
(1)加热A前,需先从_________(填“a”或“b”)口向B中通入水。
(2)写出步骤②中制备正丁醚的化学方程式____________________________________。
(3)步骤③的目的是初步洗去____________________,振摇后静置,粗产物应从分液漏斗的_____(填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为_______________________________________。
(5)步骤⑤中,加热蒸馏时应收集________(填选项字母)左右的馏分。
a.100℃b.117℃c.135℃d.142℃
(6)本实验中,正丁醚的产率为_____________________。
【答案】b 2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O 浓H2SO4 上 洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4 d 40%
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O 浓H2SO4 上 洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4 d 40%
【解析】
(1)冷凝水的水流方向和气流方向相反;
(2)正丁醇在浓硫酸、加热135℃条件下发生分子间脱水反应生成正丁醚;
(3)在反应混合物中,浓硫酸能溶解于水,正丁醚不溶,正丁醇微溶于水,据此分析步骤③的目的;分液漏斗中振荡静置后,上层液体中为密度比水小的正丁醚和正丁醇;
(4)步骤④中粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,氢氧化钠洗涤后,有机层中会残留NaOH及中和反应生成的盐;
(5)步骤⑤中,加热蒸馏的目的是收集正丁醇;
(6)根据方程式结合实验前提供的37g正丁醇的量计算理论上正丁醚的产量,再计算正丁醚的产率。
(1)采取逆流原理通入冷凝水,使冷凝管进行充分冷却,即从b口通入冷凝水,故答案为:b;
(2)正丁醇在浓硫酸、加热135℃条件下发生分子间脱水反应生成CH3CH2CH2CH2OCH2CH2CH2CH3,反应方程式为:2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,故答案为:2CH3CH2CH2CH2OH
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,故答案为:2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O;
(3)用水可以洗去混有的浓H2SO4;正丁醇、正丁醚不溶于水,溶液分层,粗产品的密度小,故答案为:浓H2SO4;上;
(4)步骤④中最后一次水洗,可以洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4,故答案为:洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4;
(5)正丁醚沸点为142℃,粗产品中含有正丁醇,其沸点为117.2℃,低于正丁醚的沸点,加热蒸馏正丁醇先汽化,加热蒸馏时应收集142℃左右的馏分,故答案为:d;
(6)由2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,可知37g正丁醇完全反应得到正丁醚的质量为![]() 130g/mol=32.5g,故样品产率为
130g/mol=32.5g,故样品产率为![]() ×100%=40%,故答案为:40%。
×100%=40%,故答案为:40%。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)212H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料—铝灰(含 Al、Al2O3 及少量 SiO2 和 FeOxFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 __,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 ______。
(2)明矾净水的原理是 ________(用离子方程式表示)。
(3)检验滤液 A 中是否存在 Fe2+ 的实验操作是 ________。
(4)在滤液 A 中加入高锰酸钾溶液的目的是 ______(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(5)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____。
(6)操作Ⅱ是 _____、______、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知293K时下列物质的溶度积![]() 单位已省略
单位已省略![]() :
:
| Ag2SO4 | FeS | CuS | Ag2S |
| 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
下列说法正确的是![]()
![]()
A.相同温度下,Ag2SO4、FeS、CuS饱和溶液中:![]()
B.向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:![]()
C.浓度均为0.004mol/L的AgNO3和H2SO4溶液等体积混合后不能产生沉淀
D.向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:

已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+ ![]()
![]()
![]()
请回答:
(1)D的名称为__________________。
(2)反应①~⑥中属于加成反应的是___________(填序号)。
(3)写出反应③的化学方程式:______________________________________;
反应④的化学方程式:_________________________________________。
(4)在实验室里鉴定![]() 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是__________(请按实验步骤操作的先后次序填写序号)。
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是__________(请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 B.加NaOH溶液 C.加热 D.用稀硝酸酸化
(5)E的同分异构体有多种,其中之一甲属于酯类。甲可由H(已知H的相对分子量为32)和芳香酸G制得,则甲的结构共有__________种。
(6)根据已有知识并结合相关信息日,写出以乙烯为原料制备CH3CH=CHCHO的合成路线流程图(无机试剂任选)。合成路线流程图例如下:_____________________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2==Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
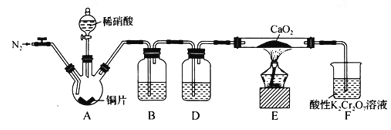
A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①将![]() 溶液和
溶液和![]() 溶液等体积混合得到浊液;②取少量①中浊液,滴加
溶液等体积混合得到浊液;②取少量①中浊液,滴加![]() 溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加
溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加![]() 溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
A. 将①中浊液过滤,所得滤液中含少量![]()
B. ①中浊液存在平衡:![]()
C. ②中沉淀颜色变化说明![]() 转化为
转化为![]()
D. ③可以证明![]() ,比
,比![]() 更难溶
更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝在酸性或碱性溶液中均可与NO3—发生氧化还原反应,转化关系如下图所示:
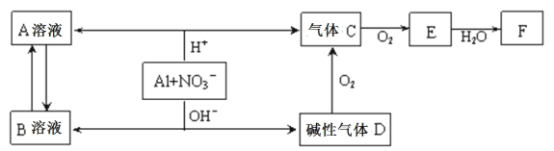
下列说法错误的是
A.B溶液含[Al(OH)4]—
B.A溶液和B溶液混合无明显现象
C.D与F反应生成盐
D.E排入大气中会造成污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加
稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的![]() 溶液中,剩余不溶物dg。下列说法不正确的是
溶液中,剩余不溶物dg。下列说法不正确的是
已知;![]() 遇到
遇到![]() 会出现蓝色沉淀。
会出现蓝色沉淀。
A. ![]()
B. 原合金中铜的质量为![]()
C. 若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() (标准状况下)
(标准状况下)
D. d不是一确定值,可能为8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com