
| A. | 稀硫酸、NaCl溶液是实验室常见的强电解质 | |
| B. | 二氧化氮经加压凝成无色液体为物理变化 | |
| C. | Na2O•SiO2是一种简单的硅酸盐,可溶于水 | |
| D. | 溴水滴入植物油中振荡褪色,说明溴被植物油从溴水中萃取出来 |
分析 A、强电解质是在水溶液中或熔融状态下能完全电离的化合物;
B、二氧化氮中存在平衡:2NO2?N2O4;
C、Na2O•SiO2即Na2SiO3;
D、植物油是不饱和的高级脂肪酸和甘油形成的酯类.
解答 解:A、强电解质是在水溶液中或熔融状态下能完全电离的化合物,由于稀硫酸和氯化钠溶液是混合物,故不是电解质,更不是强电解质,故A错误;
B、二氧化氮中存在平衡:2NO2?N2O4,加压时,平衡右移,凝结成无色的四氧化二氮,为化学变化,故B错误;
C、Na2O•SiO2即Na2SiO3,是一种简单的硅酸盐,可溶于水,故C正确;
D、植物油是不饱和的高级脂肪酸和甘油形成的酯类,结构中含碳碳双键,故将溴水滴入后能和溴水发生加成反应而使溴水褪色,不是萃取,故D错误.
故选C.
点评 本题考查了强电解质的概念以及平衡的移动,应注意的是植物油与溴水发生的是加成而不是萃取.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | N≡N | H-N |
| 键能 | 436 kJ/mol | x | 391kJ/mol |
| A. | 431kJ/mol | B. | 946kJ/mol | C. | 649kJ/mol | D. | 869kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
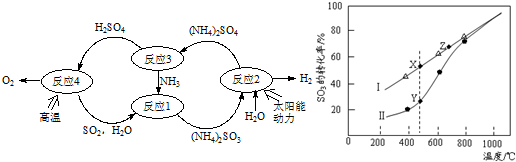
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Fe(Al)粉 | NaOH溶液 | 在过量的NaOH溶液中充分反应后过滤 |
| B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| C | FeCl2(FeCl3)溶液 | Fe粉 | 加入过量Fe粉,充分反应后过滤 |
| D | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
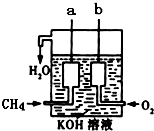 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
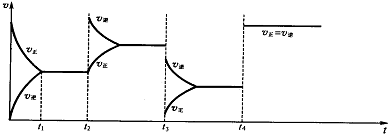
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com