
【题目】工业制得的氮化铝(AlN)产品中常含有少量 Al4C3、Al2O3 、C 等杂质。某化学实验小组设计了如下实验, 分别测定氮化铝(AlN)样品中 AlN 和 Al4C3 的质量分数(忽略NH3在强碱溶液中的溶解)。
(1)实验原理:
①Al4C3与硫酸发生复分解反应,写出该反应的化学方程式 ___________。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN和NaOH溶液反应的化学方程式_______。实验装置如下图所示:
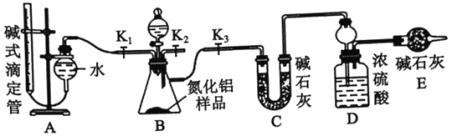
(2)实验过程:
①根据题干信息:连接实验装置,检查装置气密性。称得D装置的质量为y g,滴定管的读数为amL。该步骤中,检查装置A气密性的操作为___________。
②称取x g AlN 样品置于锥形瓶中; 塞好胶塞, 关闭活塞K2、K3,打开活塞 K1,通过分液漏斗加入足量的____(填化学式),与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3, 通过分液漏斗加入过量_________(填化学式),与锥形瓶内溶质充分反应。
④_____(填入该步应进行的操作)。
⑤实验中记录滴定管的读数为b mL,称得D装置的质量为z g。
(3)数据
①AlN 的质量分数为____________。
②若读取滴定管中气体的体积时,先冷却到室温,再__________,然后平视凹液面读数。液面左高右低,则所测气体的体积___________(填“偏大”“偏小”或“无影响”)。
③Al4C3的质量分数为 ____________(该实验条件下气体摩尔体积为Vm molL-1) 。
【答案】Al4C3 + 6H2SO4 = 2Al2(SO4)3 + 3CH4↑ AlN + NaOH + H2O = NaAlO2 + NH3↑ 关闭活塞 K1,向碱式滴定管中加水至碱式滴定管中液面高于球型干燥管中液面,如果能形成稳定的液面差则气密性良好 H2SO4 NaOH 打开K2,通入空气一段时间 ![]() ×100% 调节碱式滴定管中液面与球型干燥管中液面相平 偏小
×100% 调节碱式滴定管中液面与球型干燥管中液面相平 偏小 ![]() ×100%
×100%
【解析】
AlN溶于强酸产生铵盐,溶于强碱生成氨气,Al4C3与硫酸发生复分解反应放出甲烷。从实验装置和实验步骤可知,本实验的原理是通过A装置收集甲烷并测定甲烷的体积,通过D装置吸收生成的氨气,并测定生成氨气的质量,因此首先用足量硫酸与样品中AlN 、Al4C3完全反应,量取生成的甲烷气体,从而可测得Al4C3的百分含量;再用足量NaOH溶液与生成的铵盐反应放出氨气,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数,以此分析解答。
(1)①Al4C3与硫酸发生复分解反应生成Al2(SO4)3,结合元素守恒可知同时生成CH4, 反应的化学方程式为Al4C3+ 6H2SO4= 2Al2(SO4)3+ 3CH4↑,故答案为:Al4C3+ 6H2SO4= 2Al2(SO4)3+ 3CH4↑;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,其中AlN和NaOH溶液反应放出氨气,生成的氢氧化铝与氢氧化钠反应生成偏铝酸钠,反应的化学方程式为AlN + NaOH + H2O = NaAlO2+ NH3↑,故答案为:AlN + NaOH + H2O = NaAlO2+ NH3↑;
(2)①根据题干信息:连接实验装置,检查装置气密性。称得D装置的质量为y g,滴定管的读数为amL。该步骤中,检查装置A气密性的操作为关闭活塞K1,向碱式滴定管中加水至碱式滴定管中液面高于球型干燥管中液面,如果能形成稳定的液面差则气密性良好,故答案为:关闭活塞K1,向碱式滴定管中加水至碱式滴定管中液面高于球型干燥管中液面,如果能形成稳定的液面差则气密性良好;
②称取x g AlN 样品置于锥形瓶中; 塞好胶塞, 关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入足量的稀硫酸,与锥形瓶内物质充分反应放出甲烷气体,故答案为:H2SO4;
③待反应进行完全后,关闭活塞K1,打开活塞K3, 通过分液漏斗加入过量NaOH,与锥形瓶内溶质充分反应放出氨气,故答案为:NaOH;
④锥形瓶中有氨气剩余,需要将氨气排入D中吸收,因此操作为打开K2,通入空气一段时间,故答案为:打开K2,通入空气一段时间;
(3)①实验中称得D装置的质量为z g,即生成氨气的质量为zg,根据N元素守恒,样品中AlN 的质量为(z - y)×![]() g,则样品中AlN 的质量分数为
g,则样品中AlN 的质量分数为 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%;
×100%;
②若读取滴定管中气体的体积时,先冷却到室温,再调节碱式滴定管中液面与球型干燥管中液面相平,然后平视凹液面读数。若液面左高右低,则所测气体的体积将偏小,故答案为:调节碱式滴定管中液面与球型干燥管中液面相平;偏小;
③实验中记录滴定管的读数为b mL,即生成甲烷的体积为(a - b) mL,即甲烷的物质的量为![]() =
=![]() mol,根据C守恒,则Al4C3的物质的量为
mol,根据C守恒,则Al4C3的物质的量为![]() ×
×![]() mol,Al4C3的质量分数为
mol,Al4C3的质量分数为 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】将由Al、CuO、Fe2O3组成的混合物10.0 g放入250 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.0 mol·L-1的NaOH溶液时,得到的沉淀最多。该盐酸的浓度为( )
A.0.5 mol·L-1B.3.0 mol·L-1C.2.0 mol·L-1D.1.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、M、R 的原子半径和最外层电子数之间的关系如图所示。
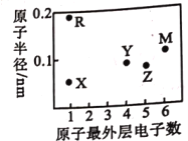
下列说法正确的是
A.化合物 RX 中含有共价键
B.Y、Z、M 的氧化物均能溶于水
C.化合物R2M 是弱电解质,其水溶液显碱性
D.试管壁上残留的M 单质可以用热的NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
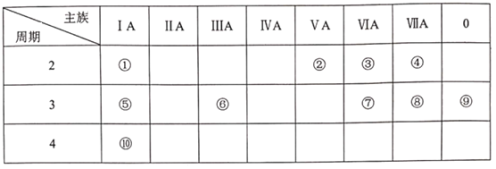
(1)⑧的单质是有毒气体, 它能与强碱稀溶液反应,其离子方程式为_________,③和⑤构成的具有漂白性的化合物,其电子式为______________。
(2)表中能形成两性氧化物的元素是____, 写出该元素的单质与⑩的最高价氧化物的水化物反应的离子方程式__________。
(3)④⑤⑦⑩四种元素简单离子半径由大到小的顺序是_____________。
(4)上述元素的最高价氧化物对应的水化物酸性最强的是______(填写化学式), 非金属气态氢化物还原性最强的是_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。装置(Ⅰ)的离子交换膜只允许Na+通过,已知电池充、放电的化学方程式为2Na2S2+NaBr3![]() Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
Na2S4+3NaBr,当闭合开关K时,X电极附近溶液变红。下列说法正确的是
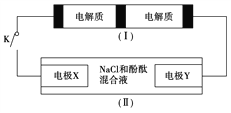
A. 闭合开关K时,Na+从右到左通过离子交换膜
B. 闭合开关K时,负极反应式为3NaBr-2e-===NaBr3+2Na+
C. 闭合开关K时,当有0.1 mol Na+通过离子交换膜时,X电极上放出标准状况下气体1.12 L
D. 闭合开关K时,X电极反应式为2Cl--2e-===Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
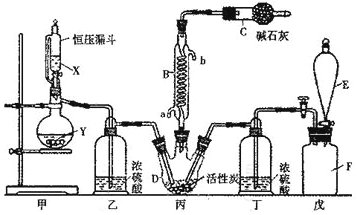
(1)仪器E的名称是_______,由B的使用可知SO2与氯气之间的反应居于______(填“放”或“吸”)热反应,B处反应管冷却水应从___________(填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是__________。
(2)试剂X、Y的组合最好是_________。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为__________%(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
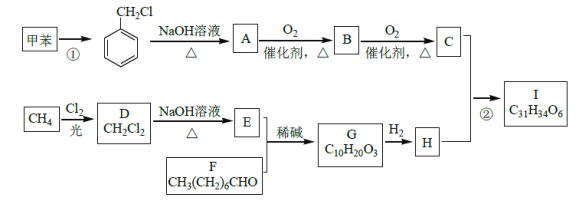
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如图:
已知:a.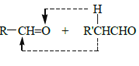
![]()
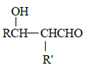
b.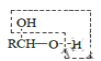
![]() RCHO
RCHO
c.E是甲醛
回答下列问题:
(1)反应①所需试剂、条件分别是___;F的化学名称为___。
(2)②的反应类型是___;A→B的化学方程式为____。
(3)G的结构简式为____;H中所含官能团的名称是___。
(4)化合物W的相对分子质量比化合物C大14,且满足下列条件,W的可能结构有___种。其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W的结构简式___。
①遇FeCl3溶液显紫色②属于芳香族化合物③能发生银镜反应
(5)设计用甲苯和乙醛为原料制备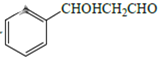 的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com