
研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 m in时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
in时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0. 2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO
2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO )、c(NO
)、c(NO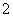 )和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
)和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
科目:高中化学 来源: 题型:
化学知识在生产和生活中有着重要的应用。下列说法中正确的是
①钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等
②K、Na合金可作原子反应堆的导热剂
③发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等
⑤碳酸钠在医疗上是治疗胃酸过多的一种药剂
A.①②③④ B.②③④⑤ C.①②③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式错误的是
A.测得0.1 mol·L-1氨水的pH为11:NH3·H2O NH4+ +OH-
NH4+ +OH-
B.将Na块投入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 Cu2++2Cl-
Cu2++2Cl-
D.将1 mol·L-1FeCl3溶液滴入沸水中,得到透明红褐色液体:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~6 min的平均反应速率:
v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
已知图一表示的是可逆反应CO(g)+H2(g)  C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)  N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是 ( )。
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是 ( )。
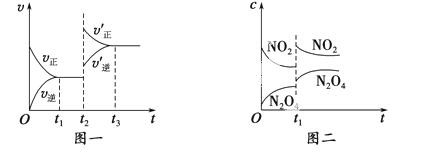
A.图一t2时改变的条件可能是升高了温度或增大了压强
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
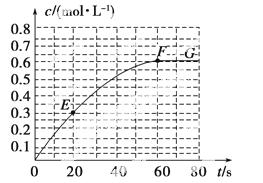
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g)2B(g) ΔH=a  kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
试回答下列问题:
(1)已知298 K时60 s达到平衡,则前60 s内A的平均反应速率为________mol·L-1·s-1。
(2)该反应的平衡常数表达式为________。
(3)若298 K时B的平衡浓度为A的3倍,323 K时( 其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的
其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的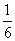 。该反应中ΔH________0(填“>”或“<”)。
。该反应中ΔH________0(填“>”或“<”)。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时B的转化率为________(填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是______________________________________________ __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)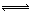 NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO( g)+Cl2(g)
g)+Cl2(g)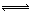 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s)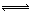 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=  (用K1、K2表示)。
(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min 内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶 液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com