
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
分析 (1)加热分解,失去结晶水,同时发生分解反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,加热后残留固体为碳酸钠,根据生成的二氧化碳计算NaHCO3的物质的量、生成Na2CO3、H2O的物质的量,再结合生成水的总质量计算结晶水的物质的量,根据质量守恒计算加热后残留固体碳酸钠的质量,进而计算晶体中碳酸钠的质量,据此确定a、b、c;
(2)①加入80mL盐酸生成气体体积为2520mL,大于加入60mL盐酸时生成的气体体积,故加入40mL、60mL盐酸时,盐酸不足,完全反应,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,加入50mL盐酸产生的气体体积为加入40mL盐酸产生的气体及在40mL基础上再加入10mL盐酸产生的气体体积之和,结合40mL~60mL之间消耗盐酸体积与生成气体体积的定比关系计算;
40mL~60mL之间消耗20mL盐酸,生成气体1680mL-560mL=1120mL,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,根据盐酸和二氧化碳之间的关系式计算盐酸浓度;
发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,生成560mL二氧化碳消耗盐酸的体积=$\frac{560mL}{1120mL}$×20mL=10mL,故加入前30mL盐酸,发生反应Na2CO3+HCl=NaCl+NaHCO3,30mL~75mL发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,由两阶段消耗的盐酸体积,可计算碱B中Na2CO3、NaHCO3的物质的量之比,再根据生成二氧化碳计算各自物质的量,根据质量守恒计算结晶水的质量,进而计算结晶水的物质的量,确定三者比例关系,进而确定碱B的化学式;
②30mL盐酸中n(HCl)=0.03mol×3mol/L=0.09mol,设碱B中Na2CO3的物质的量n mol,则为NaHCO3为0.5n mol,则:
Na2CO3+HCl=NaHCO3+NaCl+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O,
n mol nmol n mol 1.5n mol 1.5n mol 1.5n mol
当n≥n(HCl),没有气体生成;
当n<0.09且n+1.5n>0.09时,碳酸氢钠不能完全反应,盐酸先与碳酸钠反应转化为碳酸氢钠,剩余的盐酸再与碳酸氢钠反应生成二氧化碳;
当n+1.5n<0.09时,盐酸过量,根据碳元素守恒,生成二氧化碳的物质的量,据此讨论解答.
解答 解:(1)加热分解,失去结晶水,同时发生分解反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,加热后残留固体为碳酸钠,产生CO2 2.24L(标准状况),则其物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,生成水5.4g,水的物质的量=$\frac{5.4g}{18g/mol}$=0.3mol,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3 +CO2↑+H2O
0.2mol 0.1mol 0.1mol 0.1mol
故31.0g的天然碱A中,n(NaHCO3)=0.2mol,n(H2O)=0.3mol-0.1mol=0.2mol,
故m(Na2CO3)=31g-0.2mol×84g/mol-0.2mol×18g/mol=10.6g,故n(Na2CO3)=$\frac{10.6g}{106g/mol}$=0.1mol,
则碱A中n(Na2CO3):n(NaHCO3):n(H2O)=0.1mol:0.2mol:0.2mol=1:2:2,
化学式为:Na2CO3•2NaHCO3•2H2O,即a=1、b=2、c=2,
故答案为:1;2;2;
(2)①加入80mL盐酸生成气体体积为2520mL,大于加入60mL盐酸时生成的气体体积,故加入40mL、60mL盐酸时,盐酸不足,完全反应,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,40mL~50mL之间消耗10mL盐酸,生成气体体积为(1680mL-560mL)×$\frac{(50-40)mL}{(60-40)mL}$=560mL,故加入50mL盐酸产生的气体体积为:560mL+560mL=1120mL;
40mL~60mL之间消耗20mL盐酸,生成气体1680mL-560mL=1120mL,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,设盐酸的难度为c,
NaHCO3 +HCl=NaCl+CO2↑+H2O
1 1
0.02cmol $\frac{1.12L}{22.4L/mol}$
1:1=0.02cmol:$\frac{1.12L}{22.4L/mol}$
c=2.5mol/L
发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,生成560mL二氧化碳消耗盐酸的体积=$\frac{560mL}{1120mL}$×20mL=10mL,故加入前30mL盐酸,发生反应Na2CO3+HCl=NaCl+NaHCO3,30mL~75mL发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,
令碱B中Na2CO3、NaHCO3的物质的量为amol、bmol,则:
Na2CO3+HCl=NaCl+NaHCO3,
amol amol amol
NaHCO3 +HCl=NaCl+CO2↑+H2O,
(a+b)mol (a+b)mol (a+b)mol
故amol:(a+b)mol=30mL:(75mL-30mL),则a:b=2:1,由生成二氧化碳可知(a+b)mol=0.1125mol,解得a=0.075、b=0.0375,故碱B中结晶水的质量=12.45g-0.0375mol×84g/mol-0.075mol×106g/mol=1.35g,结晶水的物质的量=$\frac{1.35g}{18g/mol}$=0.075mol,
则碱B中n(Na2CO3):n(NaHCO3):n(H2O)=0.075mol:0.0375mol:0.075mol=2:1:2,
故碱B的化学式为:2Na2CO3•NaHCO3•2H2O,
故答案为:1120;2.5mol/L;2Na2CO3•NaHCO3•2H2O;
②30mL盐酸中n(HCl)=0.03mol×2.5mol/L=0.075mol,设碱B中Na2CO3的物质的量n mol,则为NaHCO3为0.5n mol,
发生反应:Na2CO3 +HCl=NaHCO3+NaCl+H2O、NaHCO3 +HCl=NaCl+CO2↑+H2O,
n mol nmol n mol 1.5n mol 1.5n mol 1.5n mol
当碱B中n(Na2CO3)≥n(HCl),即n(Na2CO3)≥0.075mol,没有气体生成,气体体积V=0,天然碱B质量W(g)满足:$\frac{W}{332}$×2≥0.075,则W≥12.45,
当n<0.075且n+1.5n>0.075时,碳酸氢钠不能完全反应,盐酸先与碳酸钠反应转化为碳酸氢钠,剩余的盐酸再碳酸氢钠反应生成二氧化碳,即:$\frac{W}{332}$×2<0.075且$\frac{W}{322}$×2×2.5>0.075,整理得4.98<W<12.45,生成二氧化碳为(0.075-$\frac{W}{332}$×2)mol,其体积V=(0.075-$\frac{W}{332}$×2)mol×22400mL/mol=(1680-$\frac{44800W}{332}$)mL,
当n+1.5n≤0.075时,碳酸氢钠完全反应,盐酸过量或恰好反应,即$\frac{W}{322}$×2×2.5≤0.075整理得W<4.98,故应0<W≤4.98,根据碳元素守恒,生成二氧化碳的物质的量=$\frac{W}{332}$mol×3,故二氧化碳体积V=$\frac{W}{332}$mol×3×22400mL/mol=$\frac{67200W}{332}$mL,
故答案为:W≥12.45g,V=0mL;4.98g<W<12.45g,V=(1680-$\frac{44800W}{332}$)mL;0<W≤4.98g,V=$\frac{67200W}{332}$mL.
点评 本题考查混合物计算、根据方程式计算,题目过程复杂繁琐,数据多,计算量大,包含字母型讨论计算,碳酸钠与盐酸的反应分两步进行,先找出完全反应点,再根据完全反应的点确定范围,综合考查学生的分析能力和计算能力,题目难度较大,属于易错题目.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | mg该硫原子的物质的量为$\frac{m}{a}$mol | B. | 该硫原子的相对原子质量为$\frac{12a}{b}$ | ||
| C. | 该硫原子的摩尔质量是aNAg•mol-1 | D. | ag该硫原子所含有的电子数为16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
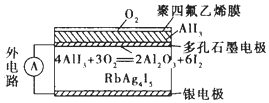 固体离子导体依靠离子迁移传导电流.如图是一种固体电池,Ag+在RbAg4I5晶体中迁移,空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池.下列说法错误的是( )
固体离子导体依靠离子迁移传导电流.如图是一种固体电池,Ag+在RbAg4I5晶体中迁移,空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池.下列说法错误的是( )| A. | I2与Ag反应属于放热反应 | |
| B. | Ag+从多孔石墨电极向银电极移动 | |
| C. | 多孔石墨电极为正极,银电极为负极 | |
| D. | 银电极的电极反应式为Ag-e-═Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示不同温度下,水溶液中H+和OH-的浓度变化,温度a>b | |
| B. |  表示30%H2O2在60℃时分解率与pH关系,说明pH越大H2O2分解率越大 | |
| C. | 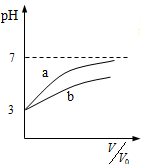 表示体积均为V0、pH均为3的盐酸和醋酸稀释时的pH变化,a表示盐酸 | |
| D. |  是等浓度NaCl和NaI溶液分别用AgNO3溶液滴定,则Ksp(AgI)>Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置制备少量氨气 | B. |  用装置从碘的CCl4溶液中分离出碘 | ||
| C. |  用装置完成喷泉实验 | D. |  用装置蒸发氯化铁溶液制备氯化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CCH3 | B. | CH2=CH2 | C. | CH≡CH | D. | CH2=C(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ/mol | |
| C. | 由石墨转化成金刚石需要吸收热量,则石墨比金刚石稳定 | |
| D. | lmol H2完全燃烧放热142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com