

| A.上述三种溶液中:c( OH-)大小:③ > ② > ① |
| B.物质酸性的比较:CH3COOH > HF > H2CO3 |
| C.反应结束后所得两溶液中: c ( CH3COO- ) > c ( F- ) |
| D.①和③反应结束后所得溶液中:c ( F- ) + c (HF) =" 0.10mol" /L |
科目:高中化学 来源:不详 题型:单选题
| A.若a≤b,混合液的pH一定小于7 |
| B.若a=2b,则混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.混合液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)一定成立 |
| D.当混合液的pH>7时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)一定成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
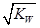 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 N2(g)+3H2(g),
N2(g)+3H2(g),| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是| A.溶液①中,C(CH3COO-)=C(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的C(CH3COO-) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+ c(CH3COOH)= C(Na+) |
| D.溶液①、③等体积混合,混合液中C(Na+)>C(CH3COO-)> C(H+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
| B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大 |
| C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变 |
D.若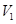 LpH=11的NaOH溶液与 LpH=11的NaOH溶液与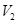 LpH=3的HA溶液混合后显中性,则 LpH=3的HA溶液混合后显中性,则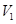 ≤ ≤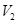 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中导电粒子的数目减少 |
| B.溶液中c(CH3COO-)/[c(CH3COOH)··c(OH-)]不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com