
【题目】元素及其化合物在生活及生产中有很多重要用途。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)第一电离能:Ga_______As(填“>”、 “<”、“=”)。
(2)B、C、N的电负性由小到大排列为_______
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S),其原因是_______。
(2)卤化物 RbICl2在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为_______;I3+属于多卤素阳离子,其空间构型为_______
(3)卤素互化物如IBr、ICl等与卤素单质结构和性质相似。Cl2、IBr、ICl沸点由高到低的顺序为_______。
(4)请推测①HC1O4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图所示),CaC2晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。此晶体中 1 个 C22﹣周围距离最近的Ca2+为_______个;若该晶胞的边长为a、a、b(pm),则该晶体的密度为_______g·cm-3(写出表达式)。

【答案】<B<C<N异硫氰酸中存在分子间氢键,而硫氰酸中无氢键RbClV形IBr>ICl>Cl2①>②>③4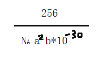
【解析】
Ⅰ.由同周期自左而右,第一电离能增大,电负性增大可知第一电离能:Ga小于As;B、C、N的电负性依次增大,故答案为< 、B<C<N;Ⅱ.(1)因在异硫氰酸分子中存在H-N键,故其分子间存在氢键,导致其沸点较高,故答案为异硫氰酸中存在分子间氢键,而硫氰酸中无氢键;(2)RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子的半径,则RbCl的离子键长小于RbI的离子键长,则RbCl的晶格能较大,则A为RbCl,I3+的成键数为2,孤对电子数为(7-1-2×1)÷2=2,与水相似,则空间构型为V形,故答案为:RbCl、V形;(3)一般结构相似的分子晶体,相对分子质量越大,沸点越高,则沸点为BrI>ICl>Cl2,故答案为BrI>ICl>Cl2;(4)一般含氧酸中含非羟基氧原子个数越多,酸性越强,①HC1O4、②HIO4、③H5IO6中的非羟基氧分别为3、3、1,但非金属性Cl>I,则酸性为①②③,故答案为:①>②>③;(5)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1 个 C22﹣周围距离最近的Ca2+为4个,而不是6个;根据均摊法可知每个晶胞中含Ca2+为(1+12÷4)=4个,含C22-为(8÷8+6÷2)=4个,则每个晶胞的质量为(4×64÷NA)g,体积为(a2b)pm3=(10-36a2b)m3=(10-30 a2b)cm3,故晶体的密度为![]() g·cm-3。
g·cm-3。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) ![]() 3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. Q点时,Y的转化率最大
B. W点X的正反应速率等于M点X的正反应速率
C. 升高温度,平衡常数增大
D. 温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫和亚硫酸钠共热可制备硫代硫酸钠(Na2S2O3),Na2S2O3是重要的化工料,易溶于水,在酸性溶液中发生如下反应:S2O32-+2H+=S↓+SO2↑+H2O。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O),并测定产品的纯度。装置如下(已略去加热装置):

(1)D是尾气处理装置,盛放的溶液可以是__________。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.饱和NaHSO3溶液
(2)C中发生的化学反应有:__________、2Na2S+3SO2=2Na2SO3+3S↓、__________。
(3)经过系列操作,该小组同学从C中制得了Na2S2O3·5H2O,此晶体中可能混有Na2SO3和Na2SO4杂质。接下来,他们做实验证明了则两种杂质的存在,请完成操作:取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,__________,沉淀未完全溶解,并有刺激性气味的气体产生(已知Ba2+与S2O32-不生成沉淀)。
(4)该组同学经讨论认为:先向A中滴加70%的H2SO4,产生的气体将装置中的空气排尽后,再向C加入Na2S和Na2CO3混合溶液,可减少装置C中生成的Na2SO4的量,画出改进后的C装置。___________

(5)测定Na2S2O3·5H2O的纯度:称取Wg产品,用适量蒸馏水溶解,滴加少量淀粉溶液,用0.1000mol·L-1碘的标准溶液滴定,反应原理为2S2O32-+I2=S4O62-+2I-。
①判断反应达到滴定至终点的标志是:______________________________。
②滴定起始和终点的液面位置如图,则产品的纯度为(Na2S2O·5H2O的摩尔质量为Mg·mol-1)____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
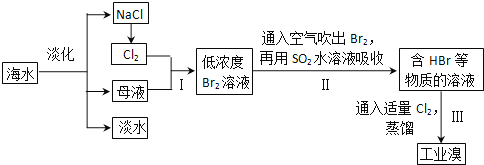
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A、NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B、BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C、NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D、Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br一,其目的是富集。发生反应的化学方程式:______________________。
(3)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
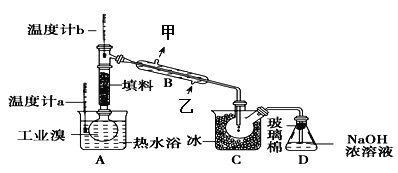
①图中仪器B的名称是______,冷却水的出口为_______(填“甲”或“乙”)。
②D装置的作用是________________。
(4)已知某溶液中Cl一、Br一、I一的物质的量之比为2:3:4,现欲使溶液中的Cl一、Br一、I一的物质的量之比变成4:3:2,那么要通入C12的物质的量是原溶液中I一的物质的量的____________(填选项)。
A、1/2 B、1/3 C、1/4 D、1/6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芥子醇是合成工程纤维的单体,结构简式如图。下列有关芥子醇的说法不正确的是

A. 分子式为C11H14O4
B. 能与浓溴水发生取代反应
C. 核磁共振氢谱显示有7个吸收峰
D. 能发生氧化、取代、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,主要表现为热量的变化。
①下列反应中,属于放热反应的是_________(填字母)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
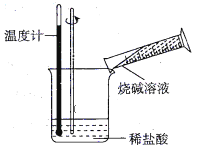
②某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明,反应温度升高;由此判断该反应是_____________(填“吸热”或“放热”)反应,其离子方程式是__________________________。
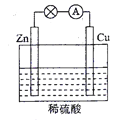
(2)电能是现代社会应用最广泛的能源之一。如图所示的原电池装置中,负极是____,正极上能够观察到的现象是________,正极的电极反应式是____________。原电池工作一段时间后,若消耗锌6.5 g,则放出气体_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锂是密度最小的金属,等质量的不同金属,锂可以释放出更多电子,故常用来制造高性能电池。已知锂的金属性介于钠和镁之间,则冶炼金属锂应采用的方法是
A. 电解法 B. 热还原法 C. 热分解法 D. 铝热法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒,在溶液中能大量共存的是( )
A.Ca2+、Cl﹣、CO32﹣、K+
B.Cu2+、Cl﹣、SO42﹣、OH﹣
C.K+、Cl﹣、NO3﹣、H+
D.H +、Cl﹣、CO32﹣、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com