
【题目】下列实验方法或操作正确的是( )
A.用标准氢氧化钠溶液滴定待测醋酸,选用酚酞作指示剂
B.配制![]() 溶液时,将
溶液时,将![]() 固体溶解在硫酸中,然后再加水稀释到所需的浓度
固体溶解在硫酸中,然后再加水稀释到所需的浓度
C.测定某溶液的pH时,用pH试纸蘸取待测液,然后和比色卡对比得出pH
D.将淀粉溶液加到饱和食盐水中,检验食盐是否是加碘食盐
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】化合物G是合成一种治疗癌症的药物的中间体,其合成路线如下:
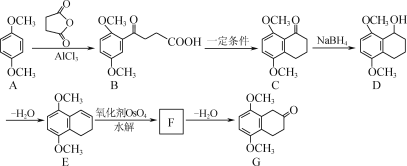
已知: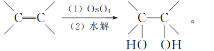
(1) C中含氧官能团为________(填名称)。
(2) D→E的反应类型为________。
(3) F的结构简式为________。
(4) G的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能发生银镜反应;② 水解产物之一能与FeCl3显色;③ 核磁共振氢谱显示有四组峰。
(5) 已知:RCOOH ![]()
![]() 请根据已有知识并结合相关信息,写出以
请根据已有知识并结合相关信息,写出以![]() 、HOOCCH2CH2COOH为原料制备
、HOOCCH2CH2COOH为原料制备![]() 的合成路线(无机试剂任用,合成路线流程图示例见本题题干)。___________
的合成路线(无机试剂任用,合成路线流程图示例见本题题干)。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是

A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水液面回升时,正极反应式为:O2+2H2O+4e-===4OH-
D.U型管中溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,将NO2加热到某温度时,可进行如下反应:2NO2(g) ![]() 2NO(g)+O2(g),达到平衡时各物质的浓度分别是c(NO2)=0.06 mol·L-1,c(NO)=0.24 mol·L-1,c(O2)=0.12 mol·L-1。试求:
2NO(g)+O2(g),达到平衡时各物质的浓度分别是c(NO2)=0.06 mol·L-1,c(NO)=0.24 mol·L-1,c(O2)=0.12 mol·L-1。试求:
(1)该反应的化学平衡常数表达式为:_______ ,值为_______。
(2)开始时NO2的浓度为_______。
(3)NO2的转化率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示。下列有关香天竺葵醇的说法错误的是
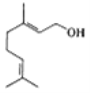
A.分子中含有两种官能团
B.该物质中的碳原子一定全部共面
C.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
D.香天竺葵醇能发生加聚反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验中配制![]() 的稀硫酸标准液,然后用其滴定某未知浓度的氢氧化钠溶液。下列有关说法中正确的是( )
的稀硫酸标准液,然后用其滴定某未知浓度的氢氧化钠溶液。下列有关说法中正确的是( )
A.实验中所用到的锥形瓶和容量瓶,在洗涤后均需要润洗
B.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,最终氢氧化钠溶液浓度将偏大
C.滴定时,左手控制酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视滴定管内液面变化
D.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容绝热密闭容器中发生CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( )
2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是( )
①容器内混合气体的平均相对分子质量不再变化;②容器内气体密度不再发生变化;
③容器内气体的压强不再发生变化; ④v正(NO):v逆(N2):v逆(CO2)=4:2:1;
A.①②③B.③④C.①②③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在2L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。下列说法不正确的是( )
N2+CO2+2H2O。在2L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。下列说法不正确的是( )
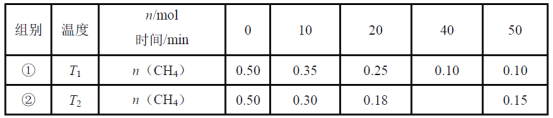
A.组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
B.由实验数据可知实验控制的温度T1<T2
C.40min时,表格中T2对应的数据为0.18
D.0~10min内,CH4的降解速率①<②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀溶液中,强酸、强碱发生中和反应生成 1 mol 液态水时,放出热量 为 57.3 kJ。下列热化学方程式中正确的是( )
A.HNO3(aq)+KOH(aq)=H2O(l)+KNO3(aq) ΔH>-57.3 kJ/mol
B.HNO3(aq)+NH3·H2O(aq)=H2O(l)+NH4NO3(aq) ΔH<-57.3 kJ/mol
C.![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+![]() H2SO4(aq)=H2O(l)+
H2SO4(aq)=H2O(l)+![]() BaSO4(s) ΔH>-57.3 kJ/mol
BaSO4(s) ΔH>-57.3 kJ/mol
D.CH3COOH(aq)+NH3·H2O(aq)=H2O(l)+CH3COONH4(aq) ΔH>-57.3 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com