
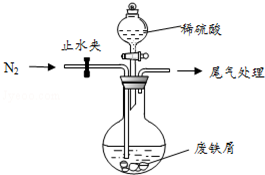
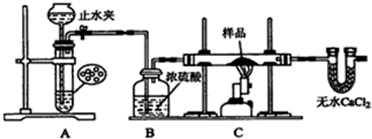
 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:分析 I.氧化铜、氧化铁与硫酸反应生成硫酸铜和硫酸铁,铁单质与硫酸铜和硫酸铁反应生成硫酸亚铁和铜单质.
(1)碳酸钠的水溶液显碱性,可以除去铁屑表面的油污;
(2)FeSO4易被氧气氧化;
(3)氧化铜、氧化铁与硫酸反应生成硫酸铜和硫酸铁,铁单质与硫酸铜和硫酸铁反应生成硫酸亚铁和铜单质;
(4)过滤,冷却结晶可得FeSO4•7H2O晶体;
II.(1)根据配制溶液的步骤以及每步操作需要仪器确定反应所需仪器;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点;
(3)Fe2+→Fe3+,铁元素化合价升高1价;MnO4-→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,根据关系式5Fe2+~MnO4-,计算25mL该液体中Fe2+的物质的量,进而计算样品中FeSO4•7H2O的质量,再根据质量分数定义计算;
(4)定容时仰视读取标准溶液体积偏大.
解答 解:I.(1)碳酸钠的水溶液显碱性,可以除去铁屑表面的油污,
故答案为:洗去铁屑表面的油污;
(2)FeSO4易被氧气氧化,持续通入N2排除装置中的空气或氧气,
故答案为:排除装置中的空气或氧气;
(3)氧化铜、氧化铁与硫酸反应生成硫酸铜和硫酸铁,铁单质与硫酸铜和硫酸铁反应生成硫酸亚铁和铜单质,
故答案为:Cu;
(4)洗涤、过滤、冷却结晶可得FeSO4•7H2O晶体,
故答案为:冷却、结晶;
II.(1)步骤为:计算→称量→溶液→转移→洗涤→定容→摇匀→装瓶→贴签,需要使用的仪器有:100mL 容量瓶,托盘天平、烧杯、玻璃棒、胶头滴管,量筒可用可不用,
故答案为:100mL 容量瓶;胶头滴管;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫红色,
故答案为:当最后一滴标准液滴入时,溶液变为紫红色,且30s保持不变;
(3)测定样品中Fe2+的含量,采用在酸性条件下KMnO4标准液滴定,Fe2+→Fe3+,铁元素化合价升高1价;MnO4-→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,故Fe2+系数为5,MnO4- 系数为1,根据元素守恒可知Mn2+与Fe3+系数分别为1、5,根据电荷守恒可知缺项为H+,H+其系数为2+3×5-[2×5-1]=8,根据H元素守恒可知H2O系数是4,所以反应离子方程式为5Fe2++MnO4-+8H+=1Mn2++5Fe3++4H2O,
令Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.1mol/L
所以x=$\frac{0.01×0.1mol/L×5}{1}$=0.005mol,
所以样品中FeSO4•7H2O的质量0.005mol×4×278g/mol=5.56g,所以4g产品中FeSO4•7H2O的质量分数为 $\frac{5.56g}{10g}$×100%=55.6%,
故答案为:55.6%;
(4)定容时仰视体积偏大,浓度偏小,故答案为:仰视.
点评 本题考查物质的制备与含量的测定,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
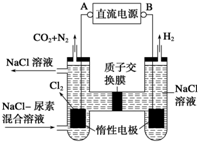
| A. | A 极为电源的负极 | |
| B. | 阳极室中发生的反应只有CO(NH2)2-6e-+6OH -=N2↑+CO2↑+5H2O | |
| C. | 阴极室溶液的 PH 电解前后保持不变 | |
| D. | 除去 3.6 克尿素时阴极一定生成 H26.72L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
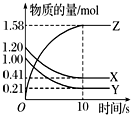 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
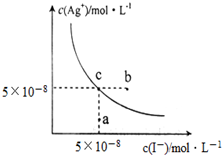 在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )
在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )| A. | 在t℃时,AgI的Ksp=2.5×10-15 mol2•L-2 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常数K=200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液不一定是中性溶液 | |
| B. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1(体积变化忽略不计) | |
| C. | 能自发进行的化学反应,一定是△H<0、△S>0 | |
| D. | NaNO2固体溶于水会促进水的电离(已知Ka(HNO2)=4.6×10-4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中肯定不含Ba2+ | |
| B. | 该溶液中除H+、0H-之外所含离子是Fe2+、Na+、NO3-、SO42- | |
| C. | 若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种 | |
| D. | 若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaN3与KN3结构类似,前者晶格能较小 | |
| B. | 第一电离能(I1):N>P>S | |
| C. | 钠晶胞结构属于体心结构,该晶胞分摊含2个钠原子 | |
| D. | 氮气常温下很稳定,是因为氮的电负性小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com