
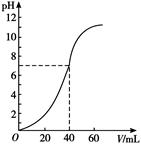
| A.0.5 mol·L-1 100 mL | B.0.5 mol·L-180 mL |
| C.1 mol·L-160 mL | D.1 mol·L-180 Ml |
科目:高中化学 来源:不详 题型:单选题
| A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.中和碱的能力相同 | B.盐酸和醋酸的物质的量浓度相同 |
| C.OH-的物质的量浓度相同 | D.H+的物质的量浓度不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
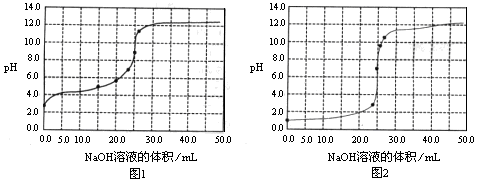
| A.滴定盐酸的pH变化曲线为图2 |
| B.在滴定CH3COOH溶液的过程中,始终都有c(Na+)+ c(H+)=c(CH3COO–)+c(OH–) |
| C.滴定CH3COOH溶液的过程中,当滴加12.5mLNaOH溶液时,溶液中离子浓度由大到小的顺序为c(CH3COO–)>c(Na+)>c(H+)>c(OH–) |
| D.当c(Na+)=c(CH3COO–)+ c(CH3COOH)时,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/L的NH4C1溶液中c(NH4+)=c(C1-) |
| B.同为0.1mol/L的甲酸和氢氧化钠溶液等体积混合后,溶液中c(OH-)=c(H+) |
| C.向NH4C1溶液中滴加氨水至pH=7时,c(NH4+)<c(C1-) |
| D.pH=3的H2SO4和pH=11的NaOH溶液等体积混合后,溶液中c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
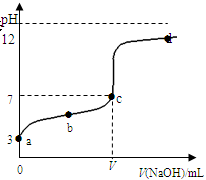
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
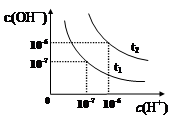
| A.t1<t2 |
| B.一定温度下,改变水溶液中c(H+)或 c(OH-)的浓度,Kw不会发生变化 |
| C.t2温度pH值为2的HCl溶液中,水电离出的c(H+)=1×10-10mol·L-1 |
| D.将t1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |

| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com