
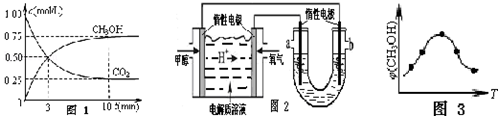
分析 依据题干条件,1g甲醇燃烧生成二氧化碳和液态水放热22.70KJ,所以32g甲醇燃烧生成二氧化碳和液态水放热726.40KJ,依据热化学方程式的书写方法写出;
(1)根据v=$\frac{△c}{△t}$,计算甲醇的反应速率,反应速率之比等于化学方程式计量数之比计算氢气的反应速率,化学平衡常数为生成物浓度幂之比与反应物浓度幂之积的比进而求得化学平衡常数,计算再充入0.75mol CO2(g)和1.5mol H2O(g),的浓度商和平衡常数比较平淡反应进行的方向;可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答;
(2)在甲醇燃料电池中,甲醇在负极失电子发生氧化反应,在正极放电的为氧气,结合酸性的电解质溶液,即写出正负极电极反应,NaCl溶液的pH值变为12,即可求出电解池中放电的H+的物质的量为0.003mol,即电解池的阴极得0.003mol电子,根据流经四个电极的电量相等,从而得出消耗甲醇的量.
(3)温度对平衡移动方向的影响判断反应的热量变化;由图可知最高点反应到达平衡,到达平衡后,温度越高,φ(CH3OH)越小,升高温度平衡向逆反应进行,据此判断;
解答 解:已知:在 25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ,32g甲醇燃烧生成二氧化碳和液态水放热726.40KJ,甲醇燃烧的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.40KJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.40KJ/mol;
(1)图象分析可知,甲醇变化浓度为0.75mol/L,甲醇的反应速率v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min ),反应速率之比等于化学方程式计量数之比,v(H2)=3v(CH3OH)=3×0.075mol/(L•min )=0.225mol/(L•min ),结合化学三行计算得到,图象分析可知体积为1L,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
该温度下平衡常数K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.3
第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),
Qc=$\frac{(0.75+1.5)×0.75}{0.25×(0.75+0.75)}$=4.5<K=5.3,反应正向进行,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)反应是气体体积减小的反应,恒温恒压密闭容器中该反应达平衡状态的依据是正逆反应速率相同是化学平衡的标志,
A.反应速率之比等于化学方程式计量数之比为正反应速率之比,当3v正(CH3OH)=v逆(H2),说明氢气正逆反应速率相同,表示反应达到平衡状态,v正(CH3OH)=3v逆(H2)不能说明反应达到平衡状态,故A错误;
B.反应前后气体质量相同,恒温恒压密闭容器中混合气体的密度不变,能说明反应达到平衡状态,故B正确;
C.甲醇和水蒸气浓度浓度和起始量变化量有关,c(CH3OH)=c(H2O)不能说明反应达到平衡状态,故C错误;
D.反应前后气体物质的量变化,混合气体的总物质的量不变说明反应达到平衡状态,故D正确;
故答案为:0.225,正向,B D;
(2)在甲醇燃料电池(电解质溶液为稀硫酸)中,正极发生还原反应,即O2放电,甲醇在负极失电子发生氧化反应,与甲醇电极相连的b为原电池阴极,与通入氧气的电极相连的a为阳极,根据电解质溶液为酸性溶液,得出正极反应为:O2+4e-+4H+=2H2O,负极电极反应为:CH3OH-6e-+H2O=CO2+6H+,
NaCl溶液的pH值变为12,即得出△n(OH-)=10-2mol/L×0.3L=0.003mol=△n(H+),根据电解池中阴极的电极反应2H++2e-=H2↑可知:
电解池的阴极得0.003mol电子.而流经四个电极的电量相等,根据燃料电池的负极反应CH3OH-6e-+H2O=CO2+6H+可知CH3OH~6e-,故失0.003mol电子时消耗0.0005mol甲醇.
故答案为:阳,CH3OH-6e-+H2O=CO2+6H+,0.0005;
(3)由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0,故答案为:<.
点评 本题考查了平衡状态的判断、化学反应速率和平衡常数的计算、原电池、电解池原理分析应用等知识,本题的难点在于对图3中平衡的判断,在达到最高点之前是建立平衡的过程,在最高点之后是受温度影响,平衡移动的过程,题目难度中等.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
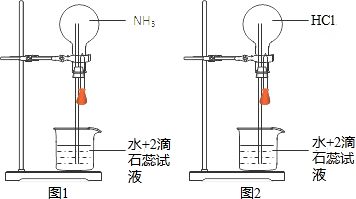
| A. | 所得溶液中溶质的物质的量浓度均为$\frac{1}{{V}_{m}}$mol•L-1 | |
| B. | “喷泉”结束时烧瓶内充满液体 | |
| C. | 图2可通过膨胀法引发“喷泉” | |
| D. | 图1、图2中喷泉的颜色分别为蓝色、红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸滴入Na[Al(OH)4]溶液中 | B. | CO2气体通入漂白粉溶液中 | ||
| C. | NaOH溶液滴入AlCl3溶液中 | D. | Ba(OH)2溶液滴入Al2(SO4)3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| |||||||||
| B. |
| |||||||||
| C. |  | |||||||||
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| C. | NaOH溶液不能保存在玻璃塞的试剂瓶中:SiO2+2OH-═SiO32-+H2O | |
| D. | 红热的铁丝与水蒸汽接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(气)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入少量KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
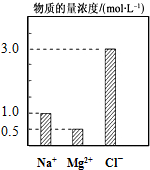 在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com