
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________L。
(2)实验中用下列装置测定SO2催化氧化为SO3的转化率(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)。

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是______。
②当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是_______________________________________________。
③实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某兴趣小组欲在绿色环保的条件下探究SO2的性质,设计如图实验装置。

B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为________;C中反应的离子方程式为___________;D中的实验现象为_______;E装置的作用是______________________。
解析:本题考查化学实验知识,意在考查考生利用化学原理分析问题的能力。(1)元素化合价升高,发生氧化反应,由反应方程式可知,被氧化的元素为S和Fe;当反应中转移2.75 mol电子时,有0.5 mol SO2生成,标况下体积为11.2 L。(2)①通过分液漏斗滴加浓硫酸时,可先打开分液漏斗上的活塞,然后旋开分液漏斗的旋塞,缓慢滴加即可。②为使残留在装置中的二氧化硫和三氧化硫被完全吸收,在熄灭酒精灯后应继续通入一段时间的氧气。③由于三氧化硫熔点较低,故D装置中增加的m g为SO3的质量,可计算出转化的SO2的物质的量为 mol,SO2通入E装置后与Ba(NO3)2溶液反应生成BaSO4,其质量为n g,由BaSO4的质量可计算出未转化的SO2的物质的量为
mol,SO2通入E装置后与Ba(NO3)2溶液反应生成BaSO4,其质量为n g,由BaSO4的质量可计算出未转化的SO2的物质的量为 mol,最后计算出二氧化硫的转化率为
mol,最后计算出二氧化硫的转化率为 ×100%。(3)检验SO2的漂白性常用品红
×100%。(3)检验SO2的漂白性常用品红
溶液;碘水具有强的氧化性,可将SO2氧化,其反应的离子方程式为SO2+I2+2H2O===SO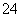 +2I-+4H+;H2S具有还原性,可与SO2发生氧化还原反应生成S,即2H2S+SO2===3S↓+2H2O,使D装置的试管中出现淡黄色沉淀;为避免SO2污染空气,可用氨水进行吸收,并用倒置漏斗防止倒吸。
+2I-+4H+;H2S具有还原性,可与SO2发生氧化还原反应生成S,即2H2S+SO2===3S↓+2H2O,使D装置的试管中出现淡黄色沉淀;为避免SO2污染空气,可用氨水进行吸收,并用倒置漏斗防止倒吸。
答案:(1)S、Fe(1分) 11.2(2分)
(2)①打开分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加(2分) ②使残留在装置中的二氧化硫和三氧化硫被充分吸收(1分) ③ ×100%(2分)
×100%(2分)
(3)品红溶液(1分) SO2+I2+2H2O===SO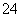 +2I-+4H+(2分) 试管中有淡黄色沉淀生成(1分) 吸收尾气,防止倒吸(2分)
+2I-+4H+(2分) 试管中有淡黄色沉淀生成(1分) 吸收尾气,防止倒吸(2分)


科目:高中化学 来源: 题型:
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。 请完成下列填空:
(1)10Be和9Be 。(填序号)
a.具有相同的化学性质 b.Be 元素的近似相对原子质量是9.5
c.具有相同的中子数 d.通过化学变化可以实现10Be和9Be间的相互转化
(2)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是 。(填序号)
a.比较这两种元素的单质的硬度和熔点
b.将空气中放置已久的这两种元素的单质分别和热水作用
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
(3)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序 (用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干操剂,此化合物的电子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应
A.强酸溶液产生较多的氢气 B.两者产生等量的氢气
C.无法比较两者产生氢气的量 D.弱酸溶液产生较多的氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示的实验装置或操作不能达到实验目的的是( )
|
|
|
|
|
| A.实验室制取氨气 | B.配制100 mL 0.1 mol/L盐酸 | C.测定中和反应的反应热 | D.实验室制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列括号内杂质的试剂和方法正确的是( )
A.Fe3+(Al3+),加过量的氨水,过滤
B. KCl溶液(BaCl2),加入足量K2SO4溶液,过滤
C.CO2(SO2),饱和碳酸钠溶液,浓硫酸,洗气
D.N2[NO2(主要)、NO],NaOH溶液,浓硫酸,洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含如下离子组中的若干种:K+、Fe3+、Fe2+、Cl-、CO 、NO
、NO 、SO
、SO 、SiO
、SiO 、I-,某同学欲探究该溶液的组成,进行如下实验:
、I-,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰。
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成。
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
A.原溶液中肯定不含Fe2+、NO 、SiO
、SiO 、I-
、I-
B.步骤Ⅱ中无色气体是NO气体,无CO2气体产生
C.原溶液中肯定含有K+、Fe3+、Fe2+、NO 、SO
、SO
D.为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
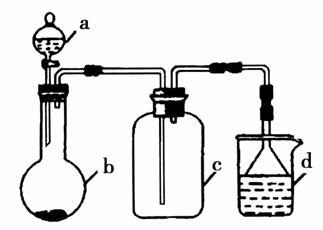
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一不可变容器中发生如下反应:2NO2  2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变
2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变
A. 密度 B.颜色 C.压强 D. 总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
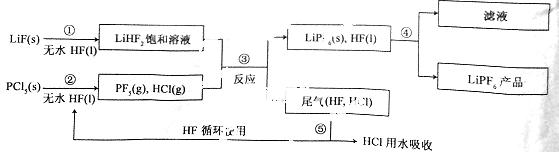
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是 、 。反应设备不能用玻璃材质的原因是 (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PCl5极易水解,其产物为两种酸,写出PCl5水解的化学方程式: 。
(3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。
(4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为 mol(用含有w、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com