
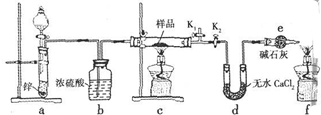
分析 Ⅰ、(1)葡萄糖分子中含有醛基,可以被新制氢氧化铜氧化生成葡萄糖酸,氢氧化铜被还原为红色氧化亚铜沉淀;
(2)制备氧化亚铜需要在试管中的葡萄糖中用胶头滴管滴加新制氢氧化铜浊液加热生成,分离出氢氧化亚铜用过滤操作分离需要烧杯、玻璃棒、漏斗等;
Ⅱ、(3)氧化亚铜不溶于水和有机溶剂,但可溶于稀盐酸、稀硫酸并生成+2价铜盐和铜单质,氧化亚铜也和硫酸发生氧化还原反应生成硫酸铜溶液显蓝色;
(4)①防止酸的挥发,应选用难挥发性的酸;装置e中碱石灰的作用是防止空气中的水进入d装置;
②打开K1,关闭K2,通一段时间氢气后验纯,验纯后应保持气体能通过d装置,使生成的水全部被d装置吸收,熄灭酒精灯之后,仍需通一段时间H2至试管冷却是防止空气进入氧化生成的铜,测定结果产生误差.
③通过测定和计算证明氧化亚铜中不含氧化铜的方法是依据元素守恒,结合Cu2O和H2反应生成Cu和H2O,依据化学方程式中的定量关系计算判断.
解答 解:Ⅰ、(1)葡萄糖还原法制Cu2O是利用葡萄糖中醛基被氢氧化铜氧化生成葡萄糖酸,氧化亚铜和水,制取氢氧化铜可用可溶性铜盐和强碱反应,葡萄糖还原法制Cu2O的化学方程式为,反应的现象是加热后沉淀由蓝色变红色;
故答案为:加热后沉淀由蓝色变红色;
(2)新制氢氧化铜氧化乙醛实验需要加热,故所需玻璃仪器为试管、酒精灯,分离生成的氧化亚铜沉淀,需要进行过滤操作,所需玻璃仪器为漏斗、玻璃棒、烧杯,
故答案为:漏斗、玻璃棒;
Ⅱ、(3)氧化亚铜也和硫酸发生氧化还原反应生成硫酸铜溶液显蓝色,反应的化学方程式为Cu2O+H2SO4=CuSO4+Cu+H2O,
故答案为:Cu2O+H2SO4=CuSO4+Cu+H2O;
(4)①d装置中的碱石灰会吸收水和酸性气体,防止a中酸挥发,故选难挥发性酸硫酸,装置e中碱石灰的作用是防止空气中的水进入d装置,m(H2O)测定不准确;
故答案为:稀硫酸;防止空气中水蒸气进入d中,导致测定生成水的质量不准确;
②装置中氢气若混有空气加热或点燃会发生爆炸,需要对可燃性气体进行验纯,打开K1,关闭K2,通一段时间氢气后验纯,验纯后应保持气体能通过d装置,使生成的水全部被d装置吸收,灼热的铜和氧气会发生反应生成氧化铜,所以熄灭酒精灯之后,仍需通一段时间H2至试管冷却是防止空气进入氧化生成的铜,测定结果产生误差,
故答案为:对氢气进行验纯;防止生成的铜在高温下被氧化为CuO,导致测定数据不准确;
③将定性检验改为定量测定便能确定样品中是否含有CuO杂质,反应后剩余固体(Cu)的质量为m1,生成水的质量为d装置增加的质量m2,反应的化学方程式为Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O,
2Cu~H2O
2 1
$\frac{{m}_{1}}{64}$ $\frac{{m}_{2}}{18}$
得到9m1=64m2,
故答案为:9m1=64m2.
点评 本题以铜的化合物为载体,考查了实验基础知识和计算技能.答题时要注意题目要求,如要求填“玻璃仪器”、化学式等,实验过程分析和物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②⑥ | C. | ④⑤ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组号 | 温度(℃) | CaCO3的状态 | 盐酸浓度(mol/L) |
| A | 20 | 块状 | 3 |
| B | 30 | 小颗粒 | 2 |
| C | 30 | 块状 | 4 |
| D | 30 | 小颗粒 | 4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电极 | 电极材料 | 电极反应式 |
| 负极 | ||
| 正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是化肥工业和基础化工的重要原料.请回答下列问题:
氨是化肥工业和基础化工的重要原料.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;
;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 增大压强一定能使化学反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com