

分析 (1)装置B是过氧化氢滴入氯化铜溶液中,氯化铜做催化剂过氧化氢分解生成氧气;硫化亚铜与氧气反应生成氧化铜和二氧化硫;
(2)某黑色固体样品的成分可能是CuO、CuS和Cu2S的一种或几种,实验测定该样品与氧气反应前后的质量变化,同时检测其气体产物,通过装置c检验生成的二氧化硫气体,通过碱石灰吸收二氧化硫和水蒸气,并干燥氧气,进入装置D和样品发生反应,生成的二氧化硫易溶于水,通过装置E防止倒吸,通过装置C检验生成的二氧化硫,通过装置装置A吸收剩余的二氧化硫;
(3)实验测定样品质量为m1,与氧气充分反应后的固体质量为m2,m1=m2,且C装置中品红褪色,说明生成了二氧化硫气体,CuS和Cu2S至少有一种,因为反应后固体质量不变,结合反应Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 ,反应前后质量不变分析判断;
(4)①过氧化氢分解生成气体,测定生成气体的时间可以判断反应速率;
②比较Fe3+含 Cu2+对H2O2分解的催化效率,需要保持其他条件相同.
解答 解:(1)装置B是过氧化氢滴入氯化铜溶液中,氯化铜做催化剂过氧化氢分解生成氧气,反应的化学方程式为:2H2O2 $\frac{\underline{\;CuCl_{2}\;}}{\;}$2H2O+O2↑,硫化亚铜与氧气反应生成氧化铜和二氧化硫,反应的化学方程式为:Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2,
故答案为:2H2O2 $\frac{\underline{\;CuCl_{2}\;}}{\;}$2H2O+O2↑; Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 ,
(2)生成氧气需要干燥,二氧化硫可以用品红溶液检验,由于二氧化硫易溶于水需要防止倒吸且进行尾气吸收,气体产物,通过装置c检验生成的二氧化硫气体,通过碱石灰吸收二氧化硫和水蒸气,并干燥氧气,进入装置D和样品发生反应,生成的二氧化硫易溶于水,通过装置E防止倒吸,通过装置C检验生成的二氧化硫,通过装置装置A吸收剩余的二氧化硫,所以气流经导管的顺序为:eabfghiedab,
故答案为:eabfghiedab;
(3)实验测定样品质量为m1,与氧气充分反应后的固体质量为m2,m1=m2,且C装置中品红褪色,说明生成了二氧化硫气体,CuS和Cu2S至少有一种,因为反应后固体质量不变,结合反应Cu2S+2O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 ,可知,反应前后固体质量不变,则样品中成分为Cu2S或CuO和Cu2S,
故答案为:只含有Cu2S或含有CuO和Cu2S;
(4)①过氧化氢分解生成氧气,实验过程中可以通过测定相同时间内生成氧气的体积或生成相同体积的氧气所需时间来表现过氧化氢的分解速率大小,
故答案为:相同时间内产生O2的体积或生成相同体积O2所需要的时间;
②比较Fe3+含 Cu2+对H2O2分解的催化效率,需要保持其他条件相同,实验方案为:分别在锥形瓶中加入等浓度等体积的FeCl3溶液和CuCl2溶液,用针筒a分别装好等浓度等体积的H2O2溶液,按照上图密封好装置,将H2O2溶液快速注射进锥形瓶,并记录等时间内b这生成氧气的体积,
故答案为:分别在锥形瓶中加入等浓度等体积的FeCl3溶液和CuCl2溶液,用针筒a分别装好等浓度等体积的H2O2溶液,按照上图密封好装置,将H2O2溶液快速注射进锥形瓶,并记录等时间内b这生成氧气的体积.
点评 本题考查了实验探究物质组成、反应现象判断、实验方案的设计、对比实验的应用等,掌握基础是解题关键,题目难度较大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
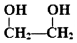 的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式
的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式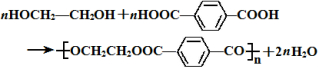 ;
;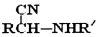 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$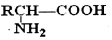
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 中①、②、③三个-OH与钠反应活性由强到弱的顺序是③>①>②.
中①、②、③三个-OH与钠反应活性由强到弱的顺序是③>①>②. ,1molF在一定条件下与足量NaOH溶液反应,做多消耗NaOH的物质的量为3 mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:
,1molF在一定条件下与足量NaOH溶液反应,做多消耗NaOH的物质的量为3 mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式: .
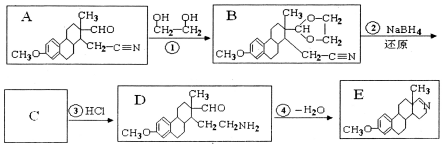
. 下列流程是A的一种合成方法,写出方框中各物质的结构简式:
下列流程是A的一种合成方法,写出方框中各物质的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应原理在科研和工农业生产中有广泛应用.
化学反应原理在科研和工农业生产中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com