
【题目】碳捕捉技术即是二氧化碳的捕集、利用与封存(CCUS),是实现温室气体减排的重要途径之一,更是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
I.利用CO2加氢合成低碳烯烃技术就是重要的应用之一。以合成C2H4为例,其合成反应为:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
(1)ΔH1=__________________(请用△H2、△H3、△H4表示),若将1mol CO2与3mol H2充入10L的恒容密闭容器中,达到平衡后,平衡浓度、CO2转化率与温度的关系分别如图1和图2所示,请回答下列问题:


(2)图1中曲线c代表物质的电子式___________________。
(3)该反应在较低温度时能自发进行,请分析其原因:______________________________。
(4)结合图1和图2,下列说法一定正确的是 __________。
A.其他条件不变,T1℃、增大压强,再次达到平衡时c(H2)比A点的c(H2)大
B.平衡常数:KM>KN
C.生成乙烯的速率:v(M)小于v(N)
(5)计算图2中M点时,乙烯的体积分数________________。(保留二位有效数字)
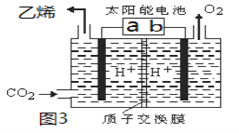
II.利用电解法也可将CO2制得乙烯,如图3所示,电极b是太阳能电池的________极,
电解时其中a极对应电解槽上生成乙烯的电极反应式为______________________________。
【答案】 6△H2-△H3+4△H4 ![]() 该反应为:ΔH<0、ΔS<0,所以低温自发 AB 7.7% 正极 2CO2+12e+12H+=C2H4+4H2O
该反应为:ΔH<0、ΔS<0,所以低温自发 AB 7.7% 正极 2CO2+12e+12H+=C2H4+4H2O
【解析】I.(1) 由题意知,H2的燃烧热为△H2,则有①H2(g)+ ![]() O2(g) = H2O(l) △H2;CH2=CH2(g)的燃烧热为△H3,则有②CH2=CH2(g)+ 3O2(g) = 2H2O(g) +2CO2(g) △H3;③H2O(l)= H2O(g) △H4。由①
O2(g) = H2O(l) △H2;CH2=CH2(g)的燃烧热为△H3,则有②CH2=CH2(g)+ 3O2(g) = 2H2O(g) +2CO2(g) △H3;③H2O(l)= H2O(g) △H4。由①![]() 6-②+③
6-②+③![]() 4可得6H2(g)+2CO2(g)
4可得6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g),所以ΔH1=6△H2-△H3+4△H4,
CH2=CH2(g)+4H2O(g),所以ΔH1=6△H2-△H3+4△H4,
(2)由图1可知,随温度升高,氢气的平衡浓度增大,所以该反应为放热反应。根据图中曲线的变化趋势可知,c的变化量小于b,所以c代表的物质是乙烯,其电子式为![]() 。
。
(3) 该反应ΔH<0、ΔS<0,该反应在较低温度时ΔH-TΔS<0,所以能自发进行。
(4)结合图1和图2的信息可知:A.其他条件不变,T1℃、增大压强,各组分的浓度均变大,尽管平衡向正反应方向移动,根据平衡移动原理可知,再次达到平衡时c(H2)比A点的c(H2)大,A正确;B.该反应为放热反应,温度升高后,平衡常数变小,所以平衡常数KM>KN,B正确;C.由图2可知,在M点催化剂的催化效率最高,远远高于N点,所以生成乙烯的速率v(M)大于v(N),C不正确。综上所述,说法一定正确的是AB。
(5)图2中M点时,二氧化碳的转化率为50%,则CO2、H2、CH2=CH2、H2O的平衡量分别为0.5mol、1.5 mol、0.25 mol、1 mol,所以乙烯的体积分数为![]() 7.7%。
7.7%。
II.由图3可知,在左室二氧化碳被还原为乙烯、右室生成氧气,所以左室为阴极室、右室为阳极室,电极b是太阳能电池的正极,电解时阴极上生成乙烯的电极反应式为2CO2+12e+12H+=C2H4+4H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中,反应2H2(g)+CO(g) ![]() CH3OH(g)达到平衡。下列说法不正确的是
CH3OH(g)达到平衡。下列说法不正确的是
容器 | 温度/K | 起始浓度/(mol/L) | 平衡浓度/(mol/L) | ||
H2 | CO | CH3OH | CH3OH | ||
① | 400 | 0.20 | 0.10 | 0 | 0.08 |
② | 400 | 0.40 | 0.20 | 0 | X |
③ | 500 | 0 | 0 | 0.10 | 0.025 |
A. X = 0.16 B. 该反应的正反应是放热反应
C. 平衡时的反应速率:②>① D. 400 K 时该反应平衡常数的值为2500
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A的结构简式如下:

(1)A的分子式是________。
(2)A在NaOH溶液中充分加热后,再加入过量的盐酸酸化后,可得到B、C、D和![]() 四种有机物,且相对分子质量大小关系为B>C>D,则B、C、D的结构简式分别是B________;C________;D________。
四种有机物,且相对分子质量大小关系为B>C>D,则B、C、D的结构简式分别是B________;C________;D________。
(3)在B的同分异构体中,属于1,3,5三取代苯的化合物的结构简式__________________。
(4)写出B与碳酸氢钠反应的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“宏观辨识与微观探析”是化学核心素养之一。
二氧化碳转化为甲醇(CH3OH)的反应微观示意图如下:

(1)B框中的物质属于_______(选填“混合物”、“化合物”、“氧化物”或“单质”)。
(2)参加反应的A、B分子个数比为_________。
(3)该反应的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程属于物理变化的是
A. 平行光照射胶体产生丁达尔效应 B. 紫外线照射下,液态蛋白质凝固
C. 铁在潮湿的空气中生锈 D. 铝遇到冷的浓硝酸发生钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对某废旧合金(含有Cu、Fe、Si三种成分)进行分离、回收。其工业流程如下:
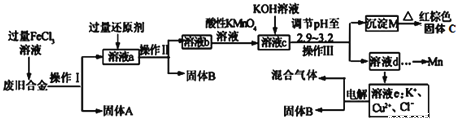
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________。
A.过滤B.洗涤C.干燥D.蒸馏
(2)过量的还原剂应是__________________,溶液a中发生的反应的离子方程式为________________________________。
(3)若用xmol/LKMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9-3.2的目的是______________________________。
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至___________。
(6)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是( )

A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C.H2O2的分子是含有极性键的非极性分子
D.在SiC和SiO2晶体中,都不存在单个小分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g).该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断错误的是( )
H2O(g)+CO(g).该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(Lmin),下列判断错误的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.10 | 0.20 | 0.20 |
c(CO2)/mol/L | 0.10 | 0.10 | 0.20 |
A. 平衡时,乙中CO2的转化率等于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/LCO2,到达平衡时c (CO)与乙相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com