
实验测得某些离子型二元化合物的熔点如下表所示,试从晶格能的变化来讨论化合物熔点随离子半径、电荷变化的规律。
化合物 | NaF | NaCl | NaBr | NaI | KCl | RbCl | CaO | BaO |
熔点/K | 1265 | 1074 | 1020 | 935 | 1041 | 990 | 2843 | 2173 |
分析:离子晶体熔点主要由晶格能决定,晶格能越大熔点越高。而晶格能又和阴、阳离子电荷及半径有关,晶格能(负值)∝![]() 。据此分下列几种情况讨论:
。据此分下列几种情况讨论:
(1)对于NaF、NaCl、NaBr、NaI,其阳离子均为Na+,阴离子电荷相同而阴离子半径大小为:r![]() <r
<r![]() <r
<r![]() <r
<r![]()
晶格能大小为:NaF>NaCl>NaBr>NaI
所以熔点高低也是NaF>NaCl>NaBr>NaI。
(2)对于NaCl、KCl、RbCl,其阴离子均为Cl-,而阳离子电荷相同,离子半径:
r![]() <r
<r![]() <r
<r![]()
则晶格能:NaCl>KCl>RbCl 。同理,CaO熔点高于BaO。
(3)对于NaF与CaO,由于它们的阴、阳离子距离差不多(![]() = 231pm
= 231pm ![]() = 239pm),故晶格能的大小决定于离子电荷数,CaO的阴、阳离子电荷数均为2,而NaF均为1,则CaO的晶格能比NaF大,所以CaO熔点高于NaF。同理BaO的熔点高于NaCl。
= 239pm),故晶格能的大小决定于离子电荷数,CaO的阴、阳离子电荷数均为2,而NaF均为1,则CaO的晶格能比NaF大,所以CaO熔点高于NaF。同理BaO的熔点高于NaCl。
解:离子晶体的熔点,随阴、阳离子电荷的增高和离子半径的减小而增高。


科目:高中化学 来源: 题型:
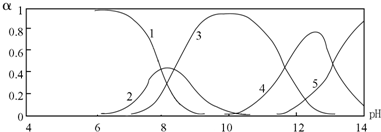
| c(NO3-) |
| c(Pb2+) |
| c(NO3-) |
| c(Pb2+) |
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg?L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg?L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2009-2010学年山东省泰安市肥城一中高三(上)期末化学综合训练(二)(解析版) 题型:解答题

 ______2(填“>”、“=”或“<”),往该溶液中滴入硫酸铵溶液后,
______2(填“>”、“=”或“<”),往该溶液中滴入硫酸铵溶液后, 增加,其原因是______;
增加,其原因是______;| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/ | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/ | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com