
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
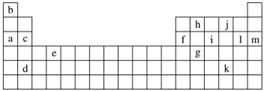
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要
的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素,则该元素属于________区。用元素符号表示X和j所能形成的化合物的化学式是__________。
③Y是周期表中________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多。
答案 (1)①④ (2)①锂原子失去核外第一个电子后即达到稳定结构,所以锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ②a s Na2O和Na2O2 ③ⅢA ④m
解析 根据位置可以判断b为H,a为Na,c为Mg,d为Sr,e为Ti,f为Al,g为Ge,h为C,i为P,j为O,k为Te,l为Cl,m为Ar。
(1)金属以及石墨为电的良导体,所以①④都符合。
(2)①由于Li失去一个电子后,达到稳定结构,所以再失去一个电子所需能量远远大于失去第一个电子所需能量。②表中所给数据即电离能,根据X的逐级电离能数据,X最外层应有1个电子,应为Na元素,即a,Na在s区,Na与j(O)可形成Na2O、Na2O2两种化合物。③根据Y的逐级电离能数据,Y最外层应有3个电子,对应的应为Al(f)。④稀有气体元素原子最稳定,失去第一个电子需要的能量最多。


科目:高中化学 来源: 题型:
已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
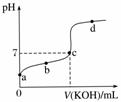
(1)a点溶液中c(H+)为________,pH约为________。
(2)a、b、c、d四点中水的电离程度最大的是________,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。
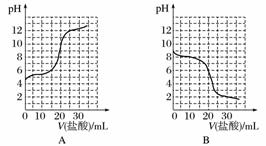

查看答案和解析>>
科目:高中化学 来源: 题型:
根据信息回答下列问题:
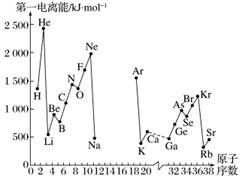
A.第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的最低能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
B.不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)认真分析信息A图中同周期元素第一电离能的变化规律,推断第三周期Na~Ar这几种元素中,Al的第一电离能的大小范围为______<Al<______(填元素符号)。
(2)从信息A图中分析可知,同一主族元素原子的第一电离能I1的变化规律是________________。
(3)信息A图中第一电离能最小的元素在周期表中的位置是________周期________族。
(4)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有________性,其中Be(OH)2显示这种性质的离子方程式是________________________________________________________________________。
(5)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围________________。
(6)请归纳元素的电负性和金属性、非金属性的关系是________________。
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物,说出理由并写出判断的方法________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于1s、2s、3s、4s原子轨道的说法,正确的是 ( )
A.电子只能在电子云轮廓图中运动
B.能级不同,电子云轮廓图形状相同
C.轨道数目相同,电子云轮廓图形状、大小完全相同
D.能层不同,电子云轮廓图形状也不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属族的族序数
B.除短周期外,其他周期均为18种元素
C.副族元素没有非金属元素
D.碱金属元素是指ⅠA族(除H外)的所有的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关σ键和π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时,只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学键的说法正确的是( )
A.构成单质分子的粒子中一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子中的化学键一定是极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H3PO4 | Ba(OH)2 |
| 非电解质 | C12H22O11 | |||
| (蔗糖) | BaSO4 | C2H5OH | H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com