
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,请回答下列问题:
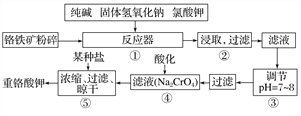
(1)以上工艺流程所涉及元素中属于过渡元素的有________,铁在周期表中的位置是第______周期______族。
(2)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_________________。
(3)NaFeO2能发生强烈水解,在步骤②中生成沉淀而除去,写出该反应的化学方程式:_________________。
(4)流程④中酸化所用的酸和流程⑤中所用的某种盐最合适的是____________(填字母)。
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸锌 D.次氯酸和次氯酸钾
酸化时,CrO![]() 转化为Cr2O
转化为Cr2O![]() ,写出平衡转化的离子方程式:________________。
,写出平衡转化的离子方程式:________________。
(5)水溶液中的H+是以H3O+的形式存在,H3O+的电子式为_____________。
(6)简要叙述操作③的目的:________________。
【答案】 Fe、Cr 四 Ⅷ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑ NaFeO2+2H2O===Fe(OH)3↓+NaOH B 2CrO
2NaAlO2+CO2↑ NaFeO2+2H2O===Fe(OH)3↓+NaOH B 2CrO![]() +2H+
+2H+![]() Cr2O
Cr2O![]() +H2O
+H2O 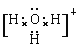 由于溶液中硅酸钠和偏铝酸钠发生水解,SiO
由于溶液中硅酸钠和偏铝酸钠发生水解,SiO![]() +H2O
+H2O![]() HSiO
HSiO![]() +OH-,HSiO
+OH-,HSiO![]() +H2O
+H2O![]() H2SiO3+OH-,AlO
H2SiO3+OH-,AlO![]() +2H2O
+2H2O![]() Al(OH)3+OH-,降低pH有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-,降低pH有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
【解析】工业上常用铬铁矿(主要成分为FeOCr2O3)为原料生产重铬酸钾:在反应器①中,6FeOCr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,NaFeO2能强烈水解,为强碱弱酸液,水解呈碱性,生成氢氧化铁沉淀,反应的化学方程式为NaFeO2+2H2O=Fe(OH)3↓+NaOH,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,操作④中酸化时,CrO42-转化为Cr2O72-,常温下重铬酸钾的溶解度较小,操作⑤中利用Na2Cr2O7+2KCl=K2Cr2O7+2NaCl复分解反应,得到重铬酸钾,据此解答。
(1)以上工艺流程所涉及元素中属于过渡元素的有Fe、Cr,铁的原子序数是26,在周期表中的位置是第四周期Ⅷ族。(2)氧化铝与碳酸钠反应生成偏铝酸钠和CO2,反应的化学方程式为Al2O3+Na2CO3![]() 2NaAlO2+CO2↑。(3)NaFeO2水解的化学方程式为NaFeO2+2H2O=Fe(OH)3↓+NaOH。(4)盐酸易挥发,所以最好用硫酸。次氯酸钾具有强氧化性,不适合与铬酸钾发生复分解反应生成重铬酸钾,应该用氯化钾,答案选B。酸化时铬酸根转化为重铬酸根离子的离子方程式为2CrO42-+2H+Cr2O72-+H2O。(5)氢离子和水分子之间存在配位键,H3O+的电子式为
2NaAlO2+CO2↑。(3)NaFeO2水解的化学方程式为NaFeO2+2H2O=Fe(OH)3↓+NaOH。(4)盐酸易挥发,所以最好用硫酸。次氯酸钾具有强氧化性,不适合与铬酸钾发生复分解反应生成重铬酸钾,应该用氯化钾,答案选B。酸化时铬酸根转化为重铬酸根离子的离子方程式为2CrO42-+2H+Cr2O72-+H2O。(5)氢离子和水分子之间存在配位键,H3O+的电子式为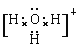 。(6)在反应器①杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,过滤后中溶液中含有铬酸根、偏铝酸根离子,需要通过调节pH转化为沉淀而除去,由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2OHSiO
。(6)在反应器①杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,过滤后中溶液中含有铬酸根、偏铝酸根离子,需要通过调节pH转化为沉淀而除去,由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2OHSiO


科目:高中化学 来源: 题型:
【题目】黑火药是我国四大发明之一,黑火药爆炸反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑其中作为氧化剂的是
A. KNO3 B. C C. KNO3和S D. KNO3 和C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中一定能说明金属A比金属B的活动性强的是( )。
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子电子层数多
C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多
D.常温时,A能从稀盐酸中置换出氢,而B不能和稀盐酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子或离子的立体构型判断不正确的是 ( )。
A.NH4+和CH4都是正四面体形
B.CO2和CS2都是直线形
C.NCl3和BCl3都是三角锥形
D.H2O和H2S都是V形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前七周期所含的元素种数如下表:
周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
由此推测第八周期最多可能含有的元素种数是( )。
A.18 B.32 C.50 D.64
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,则下列说法正确的是
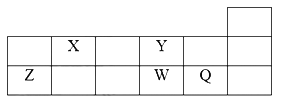
A. W的氧化物对应的水化物为强酸
B. 由Z与Y组成的物质在熔融时不能导电
C. W得电子能力比Q强
D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2和O2。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
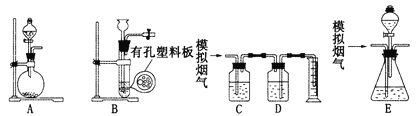
回答下列问题:
I.模拟烟气的制备
(1)用A装置制SO2的化学方程式为______________________________。
(2)用B装置制CO2,使用该装置的优点是___________________________。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
Ⅱ.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,C、D中盛放的药品分别是____、____(填序号):
①KMnO4溶液②饱和NaHSO3溶液③饱和Na2CO3溶液④饱和NaHCO3溶液
(5)若模拟烟气的流速为a mL·min-1,t1 min后,测得量筒内液体的体积为V mL则SO2的体积分数是_______________(写表达式)。
III.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeC12和FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫的目的。写出催化剂参与反应过程的离子方程式:
①SO2+2H2O+2Fe3+==SO42-+2Fe2++4H+;②______________________________。
(7)若模拟烟气仍以a mL· min-1的流速直接通过转化器E装置,t2 min后,向E装置中加入足量的盐酸酸化的BaCl2溶液得到白色浑浊液,经_______、 洗涤、_____、称量,得到m g固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于元素周期表,下列叙述中不正确的是( )。
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在金属元素区域可以寻找制备新型农药材料的元素
D.周期表中位置靠近的元素性质相近
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com