
| A. | 同温同压下,具有相同数目分子的气体必具有相同的体积 | |
| B. | 等质量的O2和H2的物质的量之比为16:1 | |
| C. | 不同的气体若体积不等,则它们所含的分子数一定不等 | |
| D. | 同温同体积下,两种气体的物质的量之比等于密度之比 |
分析 A、根据阿佛加德罗定律的内容:三同定一同来回答;
B、根据m=nM来计算;
C、根据分子数N=nNA=$\frac{V}{Vm}$NA,温度压强未知,不同的气体,若体积不等,则它们所含的分子数不能判断;
D、同温条件下气体的物质的量与其压强成正比.
解答 解:A、根据阿佛加德罗定律得到:同温同压下,具有相同数目分子的气体必具有相同的体积,故A正确;
B、等质量的O2和H2的物质的量之比为$\frac{m}{32}:\frac{m}{2}$=1:16,故B错误;
C、不同的气体,若体积不等,相同温度压强下则它们所含的分子数一定不等,但温度压强不同时,体积不同的气体有可能分子数相同,故C错误;
D、同温条件下气体,它们的物质的量与其压强成正比,所以同温同体积下两种气体的物质的量之比等于压强之比,故D错误.
故选A.
点评 本题考查了物质的量的相关计算,注意阿伏伽德罗常数概念应用、气体摩尔体积的概念和条件应用是解题关键,题目较简单.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 分散质颗粒直径都在1nm~100 nm之间 | |
| B. | 能透过半透膜 | |
| C. | 都有丁达尔效应 | |
| D. | 呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaF2难溶于水,其水溶液的导电性极弱 | |
| B. | CaF2的熔、沸点较高,硬度较大 | |
| C. | CaF2固体不导电,但在熔融状态下可以导电 | |
| D. | CaF2在有机溶剂(如苯)中的溶解度极小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胆矾(CuSO4•5H2O)是混合物 | |
| B. | 加热胆矾失去结晶水的过程是风化 | |
| C. | 氯化钙易吸水而发生潮解,所以可作干燥剂 | |
| D. | 从饱和溶液中析出的晶体都含有结晶水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
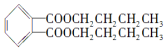 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 邻苯二甲酸二丁酯的分子式为C16H21O4 | |
| B. | 用邻苯二甲酸与1-丁醇合成邻苯二甲酸二丁酯的反应属于取代反应 | |
| C. | 邻苯二甲酸二丁酯属于酯类,可增加白酒的香味,对人体无害 | |
| D. | 邻苯二甲酸二丁酯不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氧化铜反应:O2-+2H+=═H2O | |
| B. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 碳酸钡与盐酸反应:BaCO3+2H+═Ba2++CO2↑+H2O | |
| D. | 向氯化钙溶液中通入CO2:Ca2++H2O+CO2═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol C2H6O分子中含有C-H键数为0.5NA | |
| B. | 标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA | |
| C. | 3.0 g甲醛(HCHO)和乙酸的混合物中含有的原子总数为0.4NA | |
| D. | 常温常压下,12 g冰醋酸溶解于水,其电离出的氢离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com