
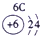
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
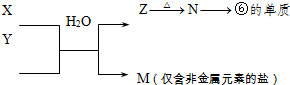
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
(15分,每空2分)
(1)Na>Cl>F (2)HClO4 H2SO4
(3)H2O2+2Fe2++2H+==2Fe3++2H2O
(4)①2Al+2NaOH+2H2O==2NaAlO2+3H2↑
②取少量A溶液滴加几滴(稀硝酸酸化的)硝酸银溶液有白色沉淀生成
③0.01 ④Al(OH)3、H2O、NaCl(3分)
【解析】
试题分析:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为O元素,③为Al元素,④为F元素,⑤为Na元素,⑥为S元素,⑦为Cl元素,
⑴电子层越多半径越大,所以Na、Cl>F,电子层一样多的原子,核电荷数越多半径越小,即Na>Cl,故答案为:Na>Cl>F④、⑤、⑦的原子半径由大到小的顺序为Na>Cl>F,答案:Na>Cl>F;⑵⑥为S元素,⑦为Cl元素,是同一周期元素的原子,根据元素周期律:从左到右最高价氧化物对应水化物的酸性逐渐增强,所以酸性:HClO4 H2SO4,答案:HClO4 H2SO4;⑶①为H元素,②为O元素,①、②两种元素按原子个数之比为1∶1组成的常见液态化合物是H2O2,H2O2具有氧化性,能将Fe2+ 氧化成Fe3+ ,方程式为:H2O2+2Fe2++2H+==2Fe3++2H2O,答案:H2O2+2Fe2++2H+==2Fe3++2H2O;
考点:元素周期律和元素周期表的综合应用


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||





查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一周期 | 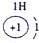 |
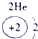 | ||||||
| 第二周期 | 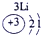 |
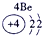 |
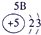 |
 |
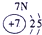 |
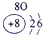 |
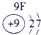 |
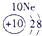 |
| 第三周期 | 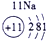 |
 |
 |
 |
 |
 | ||
 表示的是
表示的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com