
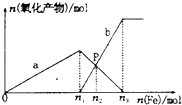
 向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )
向含有1mol HNO3和1mol H2SO4的混合溶液中逐渐加人铁粉至过量溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断不正确的是( )| A. | a表示Fe3+的关系曲线,b表示Fe3+的关系曲线 | |
| B. | P点时,n(Fe3+)=0.50 mol | |
| C. | n1=0.75 | |
| D. | n1:n3=2:3 |
分析 向含有1molHNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,先是发生反应:Fe+4H++NO3-═Fe3++NO↑(气体)+2H2O,铁过量后是2Fe3++Fe=3Fe2+,n2点时候Fe3+和Fe2+的物质的量相同,据此计算有关的量的多少.
解答 解:A、向含有1molHNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,先发生反应:Fe+4H++NO3-═Fe3++NO↑(气体)+2H2O,铁过量后先发生2Fe3++Fe=3Fe2+,故a是表示Fe3+的关系曲线,是b表示Fe2+的关系曲线,故A正确;
B、当铁过量,会有:2Fe3++Fe=3Fe2+,设Fe3+被还原Xmol,
2Fe3++Fe=3Fe2+,
2 3
X 1.5X
n2点时候Fe3+和Fe2+的物质的量相同,即0.75-X=1.5X,X=0.3,此时Fe3+的为0.45mol,故B错误;
C、向含有1molHNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,先是和H+以及NO3-反应,NO3-能将Fe氧化为Fe3+,自身还原为NO,方程式:Fe+4H++NO3-═Fe3++NO↑(气体)+2H2O,1molHNO3和1molH2SO4共有3moLH+,1mol的NO3-完全氧化需要4molH+,控制因素是H+离子,产生Fe3+离子为$\frac{3}{4}$mol,即n1=0.75mol,故C正确;
D、由于n1点时,溶液中Fe3+的为0.75mol,设n1到n3点消耗的铁粉为xmol,则根据n1到n3点发生的反应为:2Fe3++Fe=3Fe2+,
2 1
0.75mol xmol
可有:$\frac{2}{0.75mol}=\frac{1}{xmol}$,解得x=0.375mol,故n3=0.375mol+0.75mol=1.125mol,则n1:n3=2:3,故D正确.
故选B.
点评 本题涉及含铁物质间的转化知识,注意图象的分析和应用是关键,难度大,综合性强.


科目:高中化学 来源: 题型:解答题

| 错误观点 | “否定的”离子方程式 | |
| ① | 所有的离子方程式均可以表示一类化学反应 | 2Na+2H2O=2Na++2OH-+H2↑ |
| ② | 所有酸碱中和反应均可表示为 H++OH-═H2O | 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有强腐蚀性 | |
| B. | 能用于氯气、二氧化硫的干燥 | |
| C. | 可贮存在铁制容器中 | |
| D. | 可在盛有浓硫酸的烧杯中加水稀释成稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子沿外电路从锌电极流向铜电极 | |
| C. | 氮氧燃料电池工作时,氮气在负极被氧化 | |
| D. | 原电池中一定发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲醚分子中既含有极性键又含有非极性键 | |
| B. | 二甲醚与乙醛是同分异构体 | |
| C. | 在二甲醚构成的燃料电池中,每消耗0.5mol二甲醚可以向外电路提供6 mol e- | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-1455kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠在医疗上是治疗胃酸过多的一种药剂 | |
| B. | 盐酸、漂白粉属于混合物,而液氯、水玻璃均属于纯净物 | |
| C. | 玻璃、水泥、水晶项链都是硅酸盐制品 | |
| D. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L盐酸 | B. | pH=11氨水 | ||
| C. | pH=4NaHSO3溶液 | D. | 0.01mol/L Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系:
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com