
| A. | N2将完全转化为NH3 | |
| B. | N2、H2、和NH3的物质的量浓度相等 | |
| C. | N2、H2、和NH3的物质的量浓度不在变化 | |
| D. | 正反应和逆反应的速率都为零 |
分析 当可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.N2+3H2?2NH3是可逆反应,反应物不能全部转化为生成物,故A错误;
B.N2、H2、和NH3的物质的量浓度相等时,该反应不一定达到平衡状态,与反应物初始物质的量、转化率有关,所以不能据此判断平衡状态,故B错误;
C.N2、H2、和NH3的物质的量浓度不在变化时,正逆反应速率相等,能说明达到平衡状态,故C正确;
D.化学平衡状态是动态平衡,当反应达到平衡状态时,正反应和逆反应相等,但是速率不为零,故D错误;
故选C.
点评 本题考查化学平衡状态的判断,只有反应前后改变的物理量不变时该反应达到平衡状态,正确选取判断平衡状态的物理量是解本题关键,注意反应前后气体体积之和不变的可逆反应,题目难度不大.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
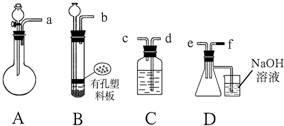
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
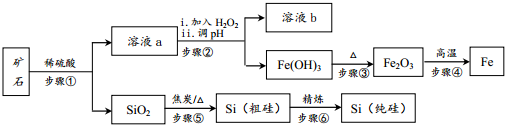
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
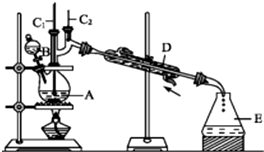 正丁醛是一种化工原料.
正丁醛是一种化工原料.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①④⑥ | C. | ②③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变反应条件使平衡向正反应方向移动,反应物的转化率一定增大 | |
| B. | 浓度变化引起平衡向正反应方向移动,反应物的转化率一定增大 | |
| C. | 温度或压强的变化引起平衡向正反应方向移动,反应物的转化率一定增大 | |
| D. | 催化剂可使化学反应速率加快,使反应物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠原子失电子能力比镁弱 | B. | 水比硫化氢稳定 | ||
| C. | 硅酸比磷酸酸性强 | D. | 氢氧化钙比氢氧化锶碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m值为3 | |
| B. | B的转化率为20% | |
| C. | A的平均反应速率为0.1mol•L-1•min-1 | |
| D. | 平衡时反应混合物总物质的量为1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com