
【题目】Ⅰ.下图是研究甲烷与氯气反应的实验装置图。
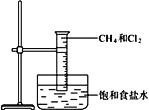
(1)CCl4的电子式:________________。
(2)二氯甲烷_____________同分异构体(填“有”或“没有”)。
(3)请完成一氯甲烷与氯气发生反应的化学方程式:CH3Cl+Cl2![]() ________+HCl,该反应属于反应_________(填有机反应类型)。
________+HCl,该反应属于反应_________(填有机反应类型)。
Ⅱ.(4)写出下列有机物的结构简式:
①2,2﹣二甲基戊烷:_____________
②3﹣甲基﹣1﹣丁烯:________________
【答案】  没有 CH2Cl2 取代反应 CH3C(CH3)2CH2CH2CH3 CH2=C(CH3)CH2CH3
没有 CH2Cl2 取代反应 CH3C(CH3)2CH2CH2CH3 CH2=C(CH3)CH2CH3
【解析】(1)CCl4的电子式为: ;(2)因为甲烷的空间构型是正四面体,所以二氯甲烷没有同分异构体;(3)一氯甲烷与氯气发生取代反应生成二氯甲烷和氯化氢,反应的化学方程式:CH3Cl+Cl2
;(2)因为甲烷的空间构型是正四面体,所以二氯甲烷没有同分异构体;(3)一氯甲烷与氯气发生取代反应生成二氯甲烷和氯化氢,反应的化学方程式:CH3Cl+Cl2![]() CH2Cl2+HCl;(4)①2,2﹣二甲基戊烷,主链为戊烷,在2号C上含有2个甲基,该有机物的结构简式为:CH3C(CH3)2CH2CH2CH3;②3﹣甲基﹣1﹣丁烯主链为丁烯,碳碳双键在1号C,在3号C上含有1个甲基,该有机物的结构简式为:CH2=CHCH(CH3)CH3。
CH2Cl2+HCl;(4)①2,2﹣二甲基戊烷,主链为戊烷,在2号C上含有2个甲基,该有机物的结构简式为:CH3C(CH3)2CH2CH2CH3;②3﹣甲基﹣1﹣丁烯主链为丁烯,碳碳双键在1号C,在3号C上含有1个甲基,该有机物的结构简式为:CH2=CHCH(CH3)CH3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于甲苯的实验事实中,能说明侧链对苯环性质有影响的是:
A.甲苯通过硝化反应生成三硝基甲苯 B.甲苯能使酸性高锰酸钾溶液褪色
C.甲苯燃烧时产生浓烈的黑烟 D.1mol甲苯可与3mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3 是一种重要的化工原料,工业上用 H2、N2合成。
(1)工业上由焦炭或天然气制氢气的过程中会产生一氧化碳。为了尽量除去氢气中混有的 一氧化碳,可在催化剂存在的条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
CO2(g)+H2(g)△H=﹣41.0kJ/mol 该反应在工业上被称为“一氧化碳变换”反应。
①在一个容积为 2L 的恒温密闭容器中加入 1molCO 和 3molH2O(g),发生上述反应,5min 后达到平衡,测得放出热量为 20.5kJ,则该时间段内反应的平均速率ν(CO)=______,此温度下该反应平衡常数 K=_____。该温度下在此容器中加入 3molCO 和 1molH2O(g)发生上述反应,达到平衡后放出热 量_____20.5kJ(填“>”、“=”或“<”)。
②已知不同反应物投料比(![]() )下,平衡混合气体中 CO 的体积分数如下表所示:
)下,平衡混合气体中 CO 的体积分数如下表所示:
温度(℃)\投料比 | 1 | 3 | 5 |
200℃ | 0.70 | 0.21 | 0.02 |
从表中数据分析可知:
反应物投料比越大,CO 的平衡转化率越________(填“大”或“小”); 请推测随反应物投料比增大,H2O的平衡转化率的变化趋势是______(填字母)。
A.增大 B.减小 C.先减小后增大 D.先增大后减小
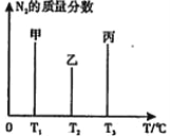
(2)用 2mol N2和3molH2合成氨,三容器的反应温度分别为 T1、T2、T3且恒定不变,在 其它条件相同的情况下,实验测得反应均进行到t min时N2的质量分数如图所示,此时甲、乙、丙三个容器中一定达到化学平衡状态的是_____,都达到平衡状态时,N2转化率最低的是________。(用“甲”、“乙”、“丙”填空)
(3)NH3与CO2在120℃,催化剂作用下可以合成反应生成尿素: CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
CO(NH2)2(s)+H2O(g)在恒温恒容的密闭容器中投入反应物后,混合气体中NH3的含量变化关系如图所示,则:
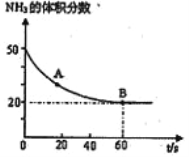
A 点的逆反应速率V逆(CO2)_____B 点的正反应速率 V正(CO2)(填“>”、 “=”或“<”);NH3的平衡转化率为____________。
(4)已知 NH2COONH4(s)![]() 2NH3(g)+CO2(g),若将一量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1____________P2, ρ1_____________________ρ2(填“>”、“=”或“<”)。
2NH3(g)+CO2(g),若将一量 NH2COONH4(s)置于恒温 密闭容器中,其分解达到平衡状态,此时容器内压强为 P1,混合气体的密度为ρ1。缩小容 器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2。则P1____________P2, ρ1_____________________ρ2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数。
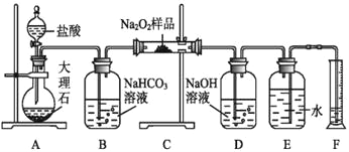
①A中发生反应离子方程式为 ____________________________________ 。
②将仪器连接好以后,必须进行的第一步操作是___________________________。
③B装置出来的气体是否需要干燥____(填“是”或“否”)。
④D中NaOH溶液的作用_______________________
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为 _______________
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的说法中,不正确的是( )
A.高压钠灯常用于道路和广场的照明
B.钠钾合金可在快中子反应堆中作热交换剂
C.工业上通过电解氯化钠溶液制取金属钠
D.钠可用于从钛、铌等金属的氯化物中置换出金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入氦气、氧气、氮气,当它们的温度和密度都相同时,这三种气体的压强(P)从大到小的顺序是( )
A.氦气>氧气>氮气
B.氧气>氮气>氦气
C.氧气>氦气>氮气
D.氦气>氮气>氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液,当后一种溶液逐滴加入到一定量的前一种溶液中并稍过量,其溶液的导电性(I表示导电能力)与后一种溶液的质量(m)的函数关系符合下图的是
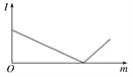
A. 澄清石灰水、碳酸钠溶液
B. 硝酸银溶液、氯化钠溶液
C. 盐酸、氢氧化钠溶液
D. 稀硫酸、氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的说法中,正确的是
A. 热稳定性:Na2CO3<NaHCO3
B. 相同温度下在水中的溶解度:Na2CO3<NaHCO3
C. 取1 mol·L-1的两种溶液,分别滴加澄清石灰水,有沉淀生成的是Na2CO3溶液
D. 取等质量的两种固体分别与等浓度等体积的盐酸反应,生成气泡较快的是NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物X、Y为起始原料可合成药物Z。下列说法正确的是( )
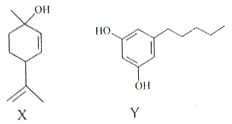
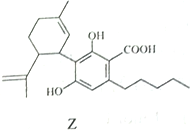
A. X分子中所有碳原子可处于同一平面 B. X、Z分子中均含有2个手性碳原子
C. 1molZ最多只能与2molBr2发生反应 D. X、Y、Z均可与NaOH稀溶液发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com