
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
分析 A.根据核外电子的排布规律:电子离核越远,能量越高;
B.氕不含中子;
C.根据核素、元素、同位素的概念和内涵进行解答;
D.根据质子数相同,而中子数或核子数不同的原子互为同位素来分析解答.
解答 解:A.根据核外电子的排布规律:电子离核越远,能量越高,在多电子的原子里,能量高的电子通常在离核远的区域内活动,故A错误;
B.1H中不含中子,故B错误;
C.核素是指具有一定数目质子和一定数目中子的一种原子,具有相同质子数,不同中子数同一元素的不同原子互为同位素,核素间互称同位素,元素是质子数(即核电荷数)相同的一类原子的总称,元素包含同位素,故C正确;
D.${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量的质量数相同,但质子数不相同,不能互为同位素,故D错误;
故选C.
点评 本题考查元素周期律应用、原子构成,深入理解各种概念的含义是解答这类题的关键,B选项中注意利用列举反例法解答,注意把握电子排布规律,题目难度不大.


科目:高中化学 来源:2017届河南省高三上第二次月考化学试卷(解析版) 题型:选择题
某无色溶液可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4- 中的几种。为确定其成分做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
A.肯定有Al3+ 、Mg2+、NH4+、Cl- B.肯定有Al3+、Mg2+、HCO3-
C.肯定有K+、HCO3-、MnO4- D.肯定有Al3+、Mg2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②③ | C. | 只有③④ | D. | 只有②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量相等 | B. | 失去电子的物质的量相等 | ||
| C. | 质量比为24:27:26 | D. | 质量比为12:18:28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应的速率相等且不为0 | B. | 反应体系中的气体压强保持不变 | ||
| C. | 正、逆反应都还在继续进行 | D. | 反应混合物中各组分的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
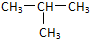 C.12C和13C
C.12C和13C 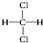 和
和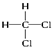
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol | |
| C. | 溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化还原反应 | |
| D. | 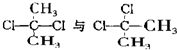 关系为同分异构体 关系为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
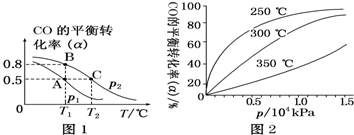 煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.
煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
必须随配随用,不能长期存放的试剂是( )
A. 氢硫酸 B. 盐酸 C. AgNO3溶液 D. NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com