
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
科目:高中化学 来源: 题型:
【题目】对于反应2SO2+O2![]() 2SO3,下列判断正确的( )
2SO3,下列判断正确的( )
A. 标准状况下,2L SO2和足量O2反应最终生成2L SO3
B. 平衡时,再向容器中通入O2,可使SO2的转化率达到100%
C. 平衡时,SO2的消耗速率必定等于O2生成速率的二倍
D. 平衡时,SO2的浓度必定等于O2浓度的二倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲在实验室中完成Fe与水蒸气反应的实验,实验装置如图甲、乙所示。

已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G 为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性?________________。
(2)乙装置中湿沙子的作用是________________。
(3)B处发生反应的化学方程式为_________________。
(4)该同学认为欲在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是________________。
(5)对比甲、乙两装置的B和K,B的优点是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8 mL NO2和O2的混合气体通入倒立于水槽中装满水的量筒,充分反应后,剩余气体为1 mL,则原混合气体中NO2和O2的体积比可能为 ( )
A. 7∶5 B. 3∶7 C. 7∶1 D. 1∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组欲探究反应2Fe2+ + I2![]() 2Fe3+ + 2I,完成如下实验:
2Fe3+ + 2I,完成如下实验:
资料:AgI是黄色固体,不溶于稀硝酸。新制的AgI见光会少量分解。

(1)Ⅰ、Ⅱ均未检出Fe3+,检验Ⅱ中有无Fe3+的实验操作及现象是:取少量Ⅱ中溶液,______。
(2)Ⅲ中的黄色浑浊是______。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。
①对Fe3+产生的原因做出如下假设:
假设a:空气中存在O2,由于______(用离子方程式表示),可产生Fe3+;
假设b:溶液中Ag+具有氧化性,可产生Fe3+;
假设c: ______;
假设d:该条件下,I2溶液可将Fe2+氧化为Fe3+。
②通过实验进一步证实a、b、c不是产生Fe3+的主要原因,假设d成立。Ⅱ→Ⅲ的过程中I2溶液氧化Fe2+的原因是______。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。
①验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,______。
② 为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
实验1:向1 mL 0.1 mol·L1 FeSO4溶液中加入1 mL0.1 mol·L1 AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。

实验2:实验开始时,先向试管中加入几滴Fe2(SO4)3溶液,重复实验1,实验结果与实验1相同。
ⅰ.实验1中发生反应的离子方程式是______。
ⅱ.Ⅳ中迅速出现灰黑色浑浊的可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲与乙在一定条件下可反应生成丙:
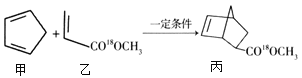
下列说法正确的是
A. 甲与乙生成丙的反应属于取代反应
B. 甲分子中所有原子共平面
C. 乙的一氯代物有2种
D. 丙在酸性条件下水解生成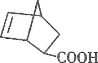 和CH318OH
和CH318OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素与我们的生活息息相关。回答下列问题:
(1)硝普钠(Na2[Fe(CN)5(NO)] 2H2O)可用于治疗急性心率衰竭。
①Fe3+的价电子轨道表示式为____________。
②硝普钠中不存在的作用力有____________(填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键 e.非极性共价键 f.氢键
③硝普钠的内界[Fe(CN)5(NO)]2-中,非金属元素的第一电离能由大到小的顺序为______,由其中两种元素按原子个数比为1:3组成的常见阴离子的空间构型为_________。
(2)三氯化铁是一种重要的铁盐,熔沸点较低,易溶于丙酮。
①FeCl3晶体类型为____________。
②FeCl3的熔点(555K)高于AlCl3(467K)的原因是_______________。
③Fe3+可用KSCN溶液检验,SCN-中σ键和π键的个数比为_______。
(3)某FexNy的晶胞如下图1所示,其化学式为____________,Cu可完全替代该晶体中的A位置Fe或B位置Fe,形成产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如下图2所示。其中更稳定的Cu替代型产物晶体的密度为ρ gcm-3,阿伏加德罗常数为NA,求晶胞参数a=___nm。
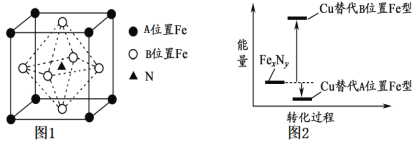
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
滤渣的成分是________,反应②的离子方程式是________。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ge(OH)4的数据如下表:
干法空气氧化法 | 氧化温度/℃ | 氧化率/% | 氧化时间/h |
暴露空气中 | 110120 | 90 | 18 |
在对流空气氧化炉中 | 110120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
(3)利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3 (如图):阳极电极反应式为______,离子交换膜为______ (填“阴”或“阳”)离子交换膜。
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成1 mol O2的同时生成2 mol NO2
②单位时间内生成1 mol O2的同时生成2 mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①②③④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com