
【题目】将装有60mLNO2、NO混合气的量筒倒立于水槽中,反应后气体体积缩小为40mL,则混合气体中NO2和NO的体积比是( )
A.5:3
B.2:3
C.1:1
D.2:1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) 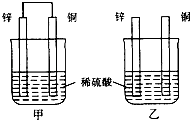
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中能够区别SO2和CO2的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤品红溶液
A. ①②③ B. ②③④ C. 除①以外 D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要化工原料,其产量是一个国家石油化工水平的标志.通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品.已知乙烯能发生如图转化: 
(1)乙烯的结构简式为 .
(2)反应①的反应类型是 , D中含官能团名称为 .
(3)写出以下反应的化学方程式:①;②;③ .
(4)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一: ![]()
工艺二: ![]()
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,在实际生产中,应采用(填“工艺一”或“工艺二”)更环保、更经济.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在锈蚀过程中,下列5种变化可能发生的是( )
①Fe由+2价转化为+3价 ②O2被还原 ③产生H2④Fe(OH)3失水形成Fe2O3·H2O ⑤杂质C被氧化除去
A.①②
B.①②③④
C.③④
D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是____和____(填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是____。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为_____(填字母)。
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
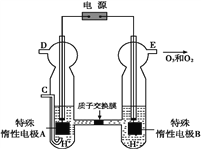
①图中阴极为____(填“A”或“B”),其电极反应式为_________________________。
②若C处通入O2,则A极的电极反应式为________,右室pH变化___________(填升高、降低、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究SO2的漂白作用到底是SO2本身具有的还是SO2与水作用的产物具有的,某学习小组设计了如图所示的装置来进行实验.请回答相关问题. 
(1)制备SO2气体的反应方程式为: . 发生装置的玻璃仪器名称为、 .
(2)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置设计中的不合理之处.
①;②
(3)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色,这说明品红褪色不是SO2直接导致的.据此,SO2能使品红的水溶液褪色的可能微粒有(不考虑水及水电离出来的粒子) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是 , 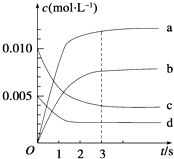
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v= .
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com