
| A、SO2使溴水褪色:SO2+Br2+2H2O═SO42-+2Br-+4H+ | ||||||
| B、稀硫酸和Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | ||||||
C、NH4HCO3溶液与过量的NaOH溶液共热:NH
| ||||||
| D、Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
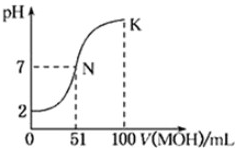 (1)常温下pH=5 HCl溶液和pH=5的AlCl3溶液中由水电离产生的c(H+)之比等于
(1)常温下pH=5 HCl溶液和pH=5的AlCl3溶液中由水电离产生的c(H+)之比等于查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑥⑦⑧ |
| B、②④⑤⑥⑦ |
| C、①③②④⑦ |
| D、①③⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯酰胺能使溴水褪色 |
| B、丙烯酰胺分子内所有的原子不可能在同一平面上 |
| C、丙烯酰胺属于一种氨基酸 |
| D、丙烯酰胺在一定条件下能水解成CH2=CHCOOH和NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法 |
| B、若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流阴极保护法 |
| C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D、若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 鉴别KCl、NH4Cl和MgCl2溶液 | 分别向三种溶液中滴加NaOH溶液至过量并加热 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②④ |
| C、②③④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
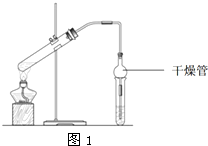 Ⅰ.下列有关操作正确的是
Ⅰ.下列有关操作正确的是| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |

查看答案和解析>>
科目:高中化学 来源: 题型:
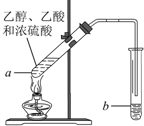 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com