
| A. | 乙烷 | B. | 乙醇 | C. | 乙酸 | D. | 蔗糖 |
分析 反应的关系式:H2~H2O~2NaOH~Na2O2•H2,CO~CO2~Na2CO3~Na2O2•CO,有机物在足量氧气中燃烧生成CO2和H2O,与Na2O2发生反应:2Na2O2+CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,对生成物变式:Na2CO3~Na2O2•CO,2NaOH~Na2O2•H2,固体增加的质量相当于CO和H2的质量,所以只要将有机物能改写为(CO)m.(H2)n的形式就符合条件.
解答 解:反应的关系式:H2~H2O~2NaOH~Na2O2•H2,CO~CO2~Na2CO3~Na2O2•CO,有机物在足量氧气中燃烧生成CO2和H2O,与Na2O2发生反应:2Na2O2+CO2=2Na2CO3+O2↑,2Na2O2+2H2O=4NaOH+O2↑,对生成物变式:Na2CO3~Na2O2•CO,2NaOH~Na2O2•H2,固体增加的质量相当于CO和H2的质量,所以只要将有机物能改写为CO.H2的形式就符合条件,
A.乙烷不能改写为(CO)m.(H2)n形式,所以不符合条件,故A错误;
B.C2H5OH改写为(CO).(H2)3.C形式,所以不符合条件,故B错误;
C.乙酸改写为(CO)2(H2)2,符合条件,故C正确;
D.蔗糖C12H22O11改写为(CO)11(H2)•C,固体质量大于ag,不符合条件,故D错误;
故选C.
点评 本题考查有机物分子式的确定,题目难度中等,明确二氧化碳、水与过氧化钠反应前后固体质量增加量成分是解本题关键,该方法能简化步骤提高解题效率,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1=V2=V3 | B. | V1>V3>V2 | C. | V2>V3>V1 | D. | V1>V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
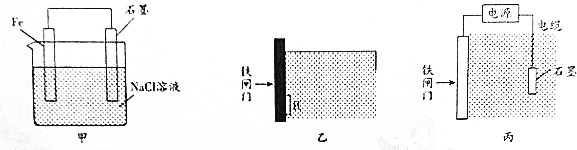
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
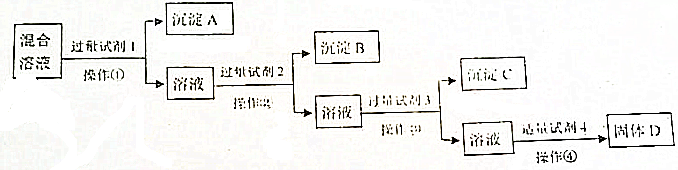
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1mo1K0H的溶液与1mo1CO2完全反应后,溶液中c(K+)>c(HCO3- ) | |
| B. | 0.2mo1/LCH3COOH溶液与0.1mo1/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 将100mL0.1mo1.L-1的醋酸稀释至pH=4:n(CH3COO-)+n(CH3COOH)=0.01mo1 | |
| D. | pH=5的NaHSO3溶液中:c(HSO3-)+c(SO32-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | pH=7 | pH=6 | pH=5 | pH=3 |
| 20℃ | 300 | 240 | 160 | 58 |
| 30℃ | 160 | 108 | 40 | 20 |
| 50℃ | 80 | 50 | x | 8 |
| A. | x可能为42 | |
| B. | 其他条件不变,在30°、pH=4下的反应速度比40℃、pH=6时快 | |
| C. | 根据单一变量法,无法比较温度、pH均不同的两组实验的反应速率较慢 | |
| D. | 30℃,pH=3条件下,KI的反应速率为v(KI)=0.005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 结合如表回答下列问题(均为25℃时的数据)
结合如表回答下列问题(均为25℃时的数据)| 酸 | 电力平衡常数(Ka) | 酸 | 电力平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com