
【题目】下表是元素周期表的一部分,回答相关的问题。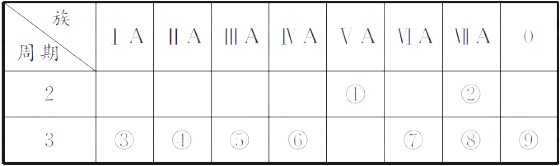
(1)写出④的元素符号。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是(填相应化学式,下同),碱性最强的是。
(4)这些元素中(除⑨外),原子半径最小的是(填元素符号,下同),原子半径最大的是。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2 , (O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)。
【答案】
(1)Mg
(2)2Na+2H2O=2Na++2OH-+H2↑
(3)HClO4;NaOH
(4)F;Na
(5)2F2+2OH-=OF2+2F-+H2O
【解析】 (1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar。(2)最活泼的金属为Na,与水反应生成NaOH与H2。(3)最高价氧化物的水化物酸性最强的是HClO4 , Na的金属性最强,故碱性最强的是NaOH。(4)同周期自左而右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,故F原子半径最小,Na原子半径最大。(5)F2与NaOH反应生成OF2 , 由电荷守恒可知生成NaF,同时生成水,离子方程式为2F2+2OH-=OF2+2F-+H2O。


科目:高中化学 来源: 题型:
【题目】回收铅蓄电池的电极填充物(铅膏,主要含PbO、PbO2、PbSO4),可制备热稳定剂三盐基硫酸铅(组成可表示为3PbOPbSO4H2O),其实验流程如下: 
(1)物质X可以循环利用,该物质是 . 最后一次过滤之后需要洗涤,检验三盐基硫酸铅是否洗净的方法是 .
(2)从滤液A可提取出一种含结晶水的钠盐副产品.若检验该晶体中结晶水的含量,所需的硅酸盐材质仪器有、、、玻璃棒、石棉网、干燥器等.
(3)流程中不直接利用H2SO4溶液与PbO、PbCO3反应制取PbSO4 , 原因可能是 .
(4)生成三盐基硫酸铅的离子反应方程式为 .
(5)向铅膏浆液中加入Na2SO4溶液的目的是将其中的PbO2还原为PbO.若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15.0%,则要将PbO2全部还原,至少需加mL 1.0molL﹣lNa2SO3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是
A.淀粉是一种天然高分子化合物
B.可以有植物油来萃取溴水中的溴单质
C.天然油脂的主要成分是高级脂肪酸甘油酯
D.工业上可以用油脂制造肥皂和油漆等化工产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的HCl气体4.48L溶于水形成100ml溶液,然后与足量的铁屑充分反应.计算:
(1)所得盐酸的物质的量浓度;
(2)生成H2的体积;
(3)将生成的FeCl2配成400ml溶液,此溶液中FeCl2的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列四种溶液:①pH=0的盐酸,②0.1molL﹣1的盐酸,③0.01molL﹣1的NaOH溶液,④pH=11的NaOH溶液中,由水电离生成的H+的物质的量浓度之比为( )
A.1:10:100:1000
B.0:1:12:11
C.14:13:12:11
D.14:13:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶 ,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )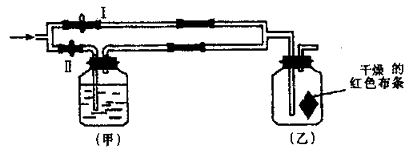
①浓H2SO4 ②浓NaOH溶液 ③KI溶液 ④饱和NaCl溶液
A.②
B.②③
C.①②③
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科研人员根据玉兔二号在第一个月昼的光谱探测数据,分析得出月幔中富含橄榄石(主要成分为:(MgFe)2SiO4),橄榄石属于
A. 碱B. 酸C. 硅酸盐D. 酸性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com