
将一定的磷化氢
(PH3)和氢气的混合气体依次通过两支加热的硬质玻璃管.第一支玻璃管中装有铜屑,第二支玻璃管中装有氧化铜.第一支玻璃管中由于发生如下反应:2PH3+3Cu科目:高中化学 来源: 题型:
(1)计算原混合气体中,磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
使一定的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第一支玻璃管中装有铜屑,第二支玻璃管中装有氧化铜,第一支玻璃管中由于发生如下反应:2PH3+3Cu![]() Cu3P2(s)+3H2,玻璃管质量增加4.96 g,第二支玻璃管中发生反应后质量减少了5.76 g。
Cu3P2(s)+3H2,玻璃管质量增加4.96 g,第二支玻璃管中发生反应后质量减少了5.76 g。
(1)计算原混合气体中,磷化氢和氢气的体积比。
(2)在标准状况下,原混合气体的密度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
磷化氢(PH3)是无色剧毒气体(沸点-89.7℃,其中含微量P2H4而易自燃。其制取原理类似于实验室制氨气,现用下图装置制取PH3并验证其性质。请回答:
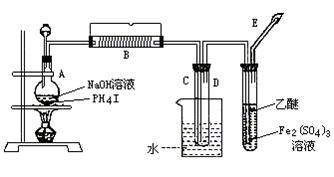
(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式______。
(2)实验开始时,先从分液漏斗中往盛有碘化磷的烧瓶A中加入过量乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2(SO4)3反应),微热数分钟后再从分液漏斗中向烧瓶里加入一定量的浓NaOH溶液继续加热。在B处用电热器控制温度在300℃左右,实验过程中可观察到:
①用水冷却的C中有白色蜡状固体生成。
②D试管中Fe2(SO4)3溶液的颜色由棕黄色变成淡绿色,同时也有白色蜡状物生成。
③E处点燃尾气,呈淡蓝色火焰。则:
C中的白色蜡状固体是(填分子式)______,能说明PH3具有______性质。试管D中反应的化学方程式是______,说明PH3具有______性。
(3)实验时E处尾气须点燃,原因是______。
(4)实验开始时,先向烧瓶中加入乙醚并微热,其目的是______。
(5)D中液面上有少量乙醚层,出现的原因是______
查看答案和解析>>
科目:高中化学 来源: 题型:
(7分)使一定的磷化氢和氢气的混合气体,依次通过两支加热的硬质玻璃管,第一支玻璃管中装有铜屑,发生反应为: ![]() ,玻璃管质量增重4.96g;第二支玻璃管中装有氧化铜,充分反应后质量减少了5.76g。 求:
,玻璃管质量增重4.96g;第二支玻璃管中装有氧化铜,充分反应后质量减少了5.76g。 求:
(1)原混合气体磷化氢和氢气的体积比。
(2)标准状况下,原混合气体的密度是多少。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com