
【题目】A.①CaCO3(s)=CaO(s)+CO2(g) ΔH=-177.7 kJ/mol
②0.5H2SO4(l)+NaOH(l)=0.5Na2SO4(l)+H2O(l) ΔH=-57.3 kJ/mol
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
④CO(g)+![]() O2(g)=CO2(g) ΔH=-283 kJ/mol
O2(g)=CO2(g) ΔH=-283 kJ/mol
⑤HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-57.3 kJ/mol
(1)上述热化学方程式中,不正确的有____________________。(填序号,以下同)
(2)上述反应中,表示燃烧热的热化学方程式是____________________________;上述反应中,表示中和热的热化学方程式是________________________。
B.已知热化学方程式:C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.41 kJ/mol;C(s,石墨)+O2(g)=CO2(g) ΔH=-393.51 kJ/mol
(3)则金刚石转化为石墨的热化学方程式为_____,由热化学方程式看来更稳定的碳的同素异形体是_____。
【答案】①② ③④ ⑤ C(s,金刚石))=C(s,石墨) ΔH=-1.9 kJ/mol 石墨
【解析】
判断热化学方程式书写是否正确,首先要保证符合基本的守恒关系,其次要正确标注各物质的聚集状态,最后要注意ΔH的数值要与化学计量系数对应,符号和单位要正确书写,至于温度和压强一般的反应不需要特殊标注。描述燃烧热的热化学方程式,务必要保证可燃物的化学计量系数为1,并且生成的是指定产物,如可燃物中的C元素转化为CO2(g),H元素转化为H2O(l)等。
A.(1)碳酸钙分解生成CO2和CaO的反应是吸热反应,因此热化学方程式①中的焓变应是正值,故①错误;硫酸与氢氧化钠的中和反应是在水溶液中进行的,因此H2SO4,NaOH和Na2SO4的聚集状态应标注为aq而非l,故②错误;
(2)热化学方程式③,④中可燃物C,CO的化学计量系数均为1,并且C元素最终都只生成了CO2(g),因此③④分别表示的是C,CO的燃烧热的热化学方程式;
(3)硝酸与氢氧化钠溶液反应只生成水,并且热化学方程式⑤中,水的化学计量系数为1,所以⑤可以表示中和热的热化学方程式;
B.由题可知1mol金刚石转化为1mol石墨的反应![]() ,所以相应的热化学方程式为:C(s,金刚石)=C(s,石墨)
,所以相应的热化学方程式为:C(s,金刚石)=C(s,石墨) ![]() ;该反应是放热反应,说明1mol石墨中存储的化学能更少,所以相同条件下,石墨更为稳定。
;该反应是放热反应,说明1mol石墨中存储的化学能更少,所以相同条件下,石墨更为稳定。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】事物是相互影响、相互制约的。在有机化合物分子中,这种相互影响、相互制约同样存在。例如:
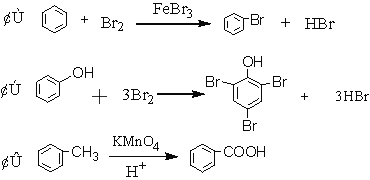
下列性质不能说明基团之间相互影响的是( )
A. ②用浓溴水而①用液溴;①需用催化剂而②不需用。
B. ②生成三溴取代产物而①只生成一溴取代产物。
C. CH3CH2OH无明显酸性,而![]() 显弱酸性。
显弱酸性。
D. 乙醇能使酸性高锰酸钾溶液褪色,而苯酚不能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列说法一定正确的是( )

A.一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+
B.一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+
C.溶液中c(H+):c(Al3+):c(Mg2+)=1:1:2
D.溶液中c(H+)/c(SO42-)![]() 2/9
2/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,盛有PbO2的圆底烧瓶中滴加浓盐酸,产生黄绿色气体,其反应的化学方程式为_______。
(2)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
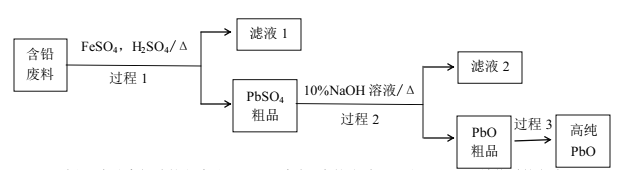
过程1中分离提纯的方法是___,滤液2中的溶质主要是____填物质的名称)。过程1中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_______。
(3)将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
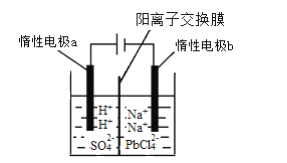
①写出电解时阴极的电极反应式_________。
②电解过程中通过阳离子交换膜的离子主要为____。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向____极室(填“阴”或者“阳”)加入____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下:

请回答下列问题:
(1)Sn(ⅣA)、As(VA)、Sb(VA)三种元素中,As和Sb最高正化合价为___________,Sn的原子序数为50,其原子结构示意图为___________。
(2)从溶液中得到锡酸钠晶体的实验操作是___________、趁热过滤、干燥。
(3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3,其作用是______________________;如图是“碱浸”实验的参数,请选择“碱浸”的合适条件_________________________________。

(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时发生的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,22.4L氖气含有的电子数为10NA
C. 常温下,![]() 的醋酸溶液中含有的
的醋酸溶液中含有的![]() 数为
数为![]()
D. 120g NaHSO4分子中阳离子和阴离子的总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
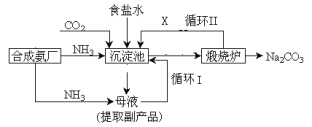
(1)写出通入CO2和NH3的化学反应方程式_________________________________________________。在 饱和食盐水中通入CO2和NH3,先通NH3后通CO2的原因是_____________________________。
(2)母液中除H+和OH-外,还含有的离子是_____________。 向母液中通氨气,加入细小食盐颗粒,冷却 析出副产品,通氨气的作用有____________。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(3)上述流程中X物质的分子式_______。使原料氯化钠的利用率从70%提高到90%以上,主要是 设计了_______(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____。
(4)写出检验产品碳酸钠中是否含有氯化钠的简要方案:___________________________________________________________________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
称取样品ag,加水溶解,加入足量的BaCl2溶液,经过滤、洗涤、干燥,最终得到固体bg。样品中纯 碱的质量分数为___________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如CH3CH=CHCH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C. X能使酸性高锰酸钾溶液褪色
D. X与足量的H2在一定条件下反应可生成饱和烃Z, Z的一氯代物有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com