
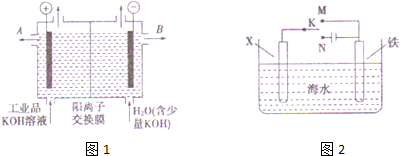
分析 (1)工业上电解熔融氧化铝冶炼Al,反应生成Al与氧气;
(2)①阳极发生氧化反应,氢氧根离子放电生成水与氧气;
②在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液,所以除去杂质后的氢氧化钾溶液从溶液出口在阴极区;
(3)为减缓铁的腐蚀,形成原电池时Fe作正极,形成电解池时Fe作阴极.
解答 解:(1)工业冶炼铝是利用惰性电极电极熔融氧化铝得到,阳极是氧离子失电子生成氧气,阴极是铝离子得到电子生成铝,反应的化学方程式为:2Al2O3 $\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
故答案为:2Al2O3 $\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(2)①用阳离子交换膜电解法除去工业品氢氧化钾溶液中的杂质含氧酸根,相当于电解水,故电解时,阳极:4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
②在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液,除杂后的氢氧化钾溶液从出口B导出,
故答案为:B;
(3)若 X 为碳棒,开关 K 应置于M处,构成原电池,Fe为负极,加速Fe的腐蚀,开关 K 应置于N处,构成原电池,Fe为阴极,被保护,减缓铁的腐蚀,
若 X 为锌,开关 K 应置于M处,构成原电池,Zn为负极,Fe被保护,减缓铁的腐蚀,为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法.
点评 本题考查原电池和电解池原理应用、金属的腐蚀和防护原理等,判断各个电极上发生的反应是解题的关键,知道金属的活泼性强弱与冶炼方法的关系,注意中学常见化学工业,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| B. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 生成等量的CuSO4时,②消耗的酸最少,且能体现绿色化学思想 | |
| B. | 反应⑥中Y可以是葡萄糖或乙醛溶液 | |
| C. | 反应④所得混合气体X中一定有O2 | |
| D. | 反应①中H2SO4与HNO3物质的量最佳比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式).Ca2++CO32-=CaCO3↓ |
| 操作2:向2mL NaHCO3溶液中滴加少量的澄清石灰水 | 白色沉淀 | 反应的离子方程式为Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (一)发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
(一)发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4敞口久置会增重 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色 | |
| D. | 在稀HNO3中放入铝片就产生NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
50mL0.50mol/L盐酸与50mL0.55mol/LNaO H溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
H溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
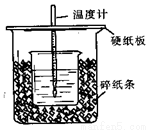
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_______________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”、“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_________(均填“偏大”、“偏小”、“无影响”);用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热的数值会__________(均填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com