
【题目】现有下列两个图象:

下列反应中符合上述图象的是( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中H2、I2各1mol·L-1进行反应H2+ I2![]() 2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
A. 小于30sB. 等于30sC. 大于30sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如下图所示。下列说法正确的是
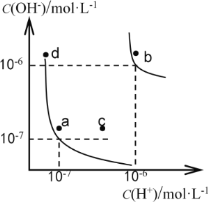
A. 图中对应点的温度关系为: a>b
B. 水的电离常数KW数值大小关系为:b>d
C. 温度不变,加入少量NaOH可使溶液从c点变到a点
D. 在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是______________________。
(2)根据上述数据,可计算出该盐酸的浓度约为___________(保留小数点后3位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用________操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___________。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。
已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式_____________________。
Ⅲ、某温度时测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数KW =_________
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是________mL。

(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL
B.是(50-a)mL
C. 一定大于amL
D.一定大于(50-a)mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应可表示为

下列说法不正确的是
A. 若A、B都是短周期元素,则B的原子序数可能是A的两倍
B. 若乙是一种常见的半导体材料,则通过该反应说明A的非金属性一定比B强
C. 若A、B均为非金属元素,则该反应过程中可能会产生白烟
D. 该反应可用于某些金属的冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。已知WO3和LiFe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色。下列有关说法不正确的是

A. 当外电流通过1mol电子时,通过离子导体层的Li+数目为NA
B. 为了获得较好的遮光效果,A应该接电源的负极
C. 该电致变色系统在较长时间的使用过程中离子导体层中Li+的量可保持基本不变
D. 当B接电源正极时,离子储存层反应为:Fe4[Fe(CN)6]3+4Li++4e-= Li4Fe4[Fe(CN)6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+B![]() C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是
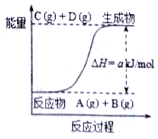
A. 产物C的能量高于反应物的总能量
B. 若该反应中有电子得失,则可设计成原电池
C. 反应物的总能量低于生成物的总能量
D. 该反应中的反应物A和B的转化率定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究性学习小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(其中硅与稀硫酸不反应)测定通常状况(约20℃,1 atm)下气体摩尔体积的方法。拟选用下列实验装置完成试验:
(1)该组同学必须选用的装置的连接顺序是(用管口字母,可不填满):A接(_____)(_____)接(_____)

(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因_________________________。
(3)实验结束时,该组同学应怎样测量实验中生成氢气的体积?____
(4)实验中准确测得4个数据:实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,实验后量筒中液面读数为VmL。则通常状况下气体摩尔体积Vm=_________。若合金中含铜,测得的Vm将________(偏大/偏小/无影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com