
| A. | F2、Cl2、Br2、I2跟氢气反应的激烈程度逐渐减小 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减小 | |
| C. | F-、Cl-、Br-、I-的还原性依次增强 | |
| D. | HF、HCl、HBr、HI水溶液的酸性依次增强 |
分析 比较非金属性的强弱,可根据①最高价氧化物对应水化物的酸性强弱、②与氢气反应的剧烈程度、③氢化物的稳定性、④单质之间的置换反应、⑤对应阴离子的还原性强弱等判断.
解答 解:A.元素的单质跟氢气反应生成气态氢化物越容易,则元素的非金属性越强,所以F2、Cl2、Br2、I2跟氢气反应的激烈程度逐渐减小可以说明F、Cl、Br、I的非金属性依次减弱,故A不选;
B.元素的非金属性越强,对应的气态氢化物的稳定性越强,所以HF、HCl、HBr、HI的热稳定性依次减小可以说明F、Cl、Br、I的非金属性依次减弱,故B不选;
C.元素的非金属性越强,对应阴离子的还原性越弱,所以F-、Cl-、Br-、I-的还原性依次增强可以说明F、Cl、Br、I的非金属性依次减弱,故C不选;
D.比较元素的非金属性强弱,可根据最高价氧化物对应水化物的酸性强弱,不是氢化物水溶液的酸性强弱,故D选;
故选D.
点评 本题考查元素非金属性的比较,题目难度不大,本题注意把握比较非金属性的方法.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 两种气体的压强相等 | B. | 两种气体的氧原子数目相等 | ||
| C. | 两种气体的分子数目相等 | D. | O2比O3的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼是原子晶体 | |
| B. | 熔化时,氯化硼能导电 | |
| C. | 氯化硼是一种离子晶体 | |
| D. | 水解方程式:BCl3+3H2O?H3BO3+3HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 用新制Cu(OH)2检验乙醛中的醛基:CH3CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m+n+2}{w}$mol | B. | $\frac{m-n+2}{m}$ mol | C. | $\frac{m+n-2}{m}$ mol | D. | $\frac{W(m-n-2)}{m}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率高 | |
| C. | t1至t2时刻该反应的速率为3mol•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
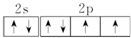 ,该元素的名称是氧;
,该元素的名称是氧;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com