
 下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
| 序号 | 已知情境 | 化学式 | 对应的离子反应方程式和现象 |
| (1) | 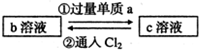 已知b溶液中滴入KSCN溶液后,溶液呈红色. |
a |
反应①的离子方程式 反应②的离子方程式 |
| (2) |  已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. 已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. |
c |
反应③的现象为 |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| A、氧化还原反应的本质是电子的转移 |
| B、化合反应一定是氧化还原反应 |
| C、物质中某元素失去电子,则此物质是氧化剂 |
| D、离子反应可能是复分解反应,但一定不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阿伏加德罗常数NA是0.012 kg l2C中所含的原子数 |
| B、2g氢气所含氢原子数目为NA |
| C、标准状况下,11.2 L NH3所含的原子数目为0.5 NA |
| D、含71 g Na2SO4的溶液中所含Na+离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5%H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中产生气泡量减少;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5%H2O2溶液和5mL 10%H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中所得溶液中c(Cl-)-c(M+)=9.9×10-7mol/L |
| B、①c(H+)-c(MOH)=1×10-8mol/L |
| C、由②中信息知MOH的电离程度<M+的水解程度 |
| D、②中所得溶液中各离子浓度大小关系为:c(M+)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| C、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、NaOH溶液中通入少量SO2:2OH-+SO2═SO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com