
| A、Al2S3 |
| B、FeS |
| C、CuS |
| D、FeCl3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、淀粉溶液中加入淀粉酶,再加入银氨溶液,出现银镜,说明淀粉已经全部水解 |
| B、除去苯中混有的苯酚,加浓溴水,然后过滤 |
| C、向澄清的苯酚钠溶液中通入CO2,可以看到澄清的溶液变浑浊 |
| D、可用水鉴别苯、四氯化碳、乙醇三种无色液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH<7的溶液一定显酸性 |
| B、25℃时,pH=5的溶液与pH=3的溶液相比,前者c(OH-)是后者的100倍 |
| C、室温下,每1×107个水分子中只有一个水分子发生电离 |
| D、在0.1mol/L的氨水中,改变外界条件使c(NH4+)增大,则溶液的pH一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定是一种物质被氧化,另一种物质被还原 |
| B、物质在变化中失去电子,此物质是氧化剂 |
| C、发生电子转移的反应一定是氧化还原反应 |
| D、发生化合价升降的反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、F2+H2O (生成F2和HF) |
| B、Na+H2O |
| C、NaH+H2O(生成H2和NaOH) |
| D、Na2O2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
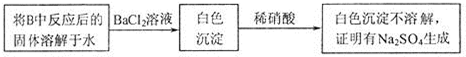
| n(SO2)的范围 | 1mol溶液中溶质的化学式 |
| (0,0.5) | |
| Na2SO3、NaHSO3 |
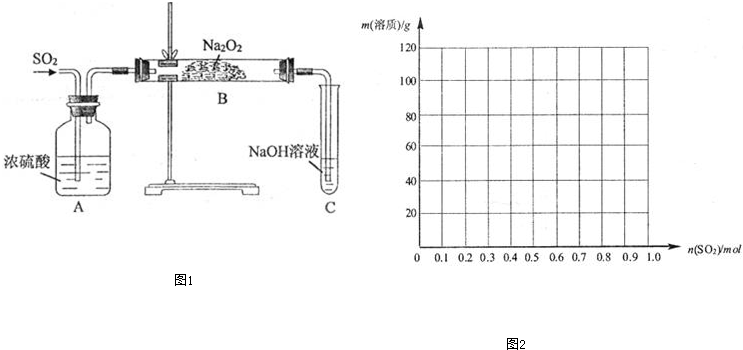
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水、液氯中均含有Cl2分子,故两者均可显黄绿色 |
| B、氯水光照射时有气泡逸出,该气体的主要成分是氯气 |
| C、Cl2可以使湿润的有色布条褪色,是因为HClO有漂白性 |
| D、新制的氯水中分子由多到少的顺序是:H2O>Cl2>HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com