
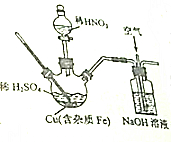
 磷酸铜可用作镀铜离子添加剂,实验室在如图所示装(夹持、加热装置省去未画)内反应生成了硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体,请回答下列问题:
磷酸铜可用作镀铜离子添加剂,实验室在如图所示装(夹持、加热装置省去未画)内反应生成了硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体,请回答下列问题:分析 (1)由于硝酸易挥发,受热易分解,所以反应温度要控制在70℃~80℃,三颈烧瓶中,用铜与稀硫酸、稀硝酸反应生成硫酸铜和一氧化氮,据此书写离子方程式;
(2)反应中有一氧化氮产生会污染空气,所以要用氢氧化钠和空气吸收尾气,根据反应后生成Na2NO3、NaNO3的物质的量之比为3:1,利用电子得失守恒可书写化学方程式;
(3)①调节反应后的溶液的pH值,为不引入新杂质且不使铜离子沉淀可用CuO,用pH试纸测溶液的pH值;
②从硫酸铜溶液中获得硫酸铜晶体,可将溶液蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、低温干燥,得到CuSO4•5H2O晶体,硫酸铜在乙醇中有溶解度较小且乙醇易挥发,硫酸铜晶体易干燥,据此答题.
解答 解:(1)由于硝酸易挥发,受热易分解,所以反应温度要控制在70℃~80℃,三颈烧瓶中,用铜与稀硫酸、稀硝酸反应生成硫酸铜和一氧化氮,反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,
故答案为:硝酸易挥发,受热易分解;3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
(2)反应中有一氧化氮产生会污染空气,所以要用氢氧化钠和空气吸收尾气,根据反应后生成NaNO2、NaNO3的物质的量之比为3:1,利用电子得失守恒可知,反应的化学方程式为8NO+3O2+8NaOH=6NaNO2+2NaNO3+4H2O,
故答案为:吸收尾气;8NO+3O2+8NaOH=6NaNO2+2NaNO3+4H2O;
(3)①调节反应后的溶液的pH值,为不引入新杂质且不使铜离子沉淀可用CuO,故选a;测量溶液pH的操作是将一小块干燥的pH试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,过一会儿,再与标准比色卡进行比对,
故答案为:a;将一小块干燥的pH试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,过一会儿,再与标准比色卡进行比对;
②从硫酸铜溶液中获得硫酸铜晶体,可将溶液蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、低温干燥,得到CuSO4•5H2O晶体,硫酸铜在乙醇中有溶解度较小,可以减少硫酸铜的损失且乙醇易挥发,硫酸铜晶体易干燥,
故答案为:蒸发浓缩、冷却结晶;减少硫酸铜的损失且易干燥.
点评 本题考查物质的性质实验探究,题目难度中等,注意把握物质的性质,为解答该题的关键,学习中注意相关知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能用铝槽车运输浓硫酸 | |
| B. | 浓硫酸能与不活泼金属在加热条件下反应 | |
| C. | 浓硫酸滴到白纸上,使白纸变黑 | |
| D. | 不活泼非金属单质能与浓硫酸反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 .
. .
. 、
、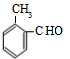 、
、 、
、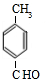 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=0.005,y=0.1 | B. | x=0.005,y=0.18 | C. | x=0.01,y=0.18 | D. | x=0.005,y=0.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com