
| 1 |
| 2 |
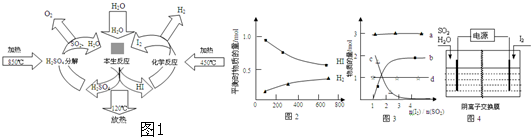
| 1 |
| 2 |
| c(H 2)c(I 2) |
| c 2(HI) |
| c(H 2)c(I 2) |
| c 2(HI) |


 �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��H+��K+��HCO3-��NO3- |
| B��OH-��Cl-��Na+��NH4+ |
| C��Cu2+��NO3-��OH-��Cl- |
| D��Mg2+��K+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��CO2���ӵı���ģ�ͣ�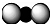 |
B��NH4Br�ĵ���ʽ��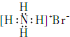 |
C����̬Feԭ�ӵ�ԭ�ӽṹʾ��ͼ��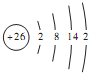 |
D����̬Alԭ�ӵļ۵����Ų�ͼ��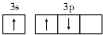 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
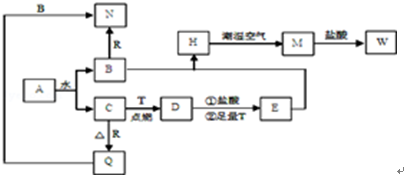
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��-283.01KJ/mol |
| B��+172.51 KJ/mol |
| C��+283.01KJ/mol |
| D��-504.01 KJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ǧ�����ڷŵ�����У�����������С�������������� |
| B������ѡ�H2+Cl2�T2HCl����Ƴ�ȼ�ϵ�أ����ڹ�ҵ�����ᣬ�����з��� |
| C����п��ϡ���ᷴӦ�������������ʽ������ټ�������CuSO4���壬���ʲ��� |
| D��ԭ��ص�����һ�����ɻ����Բ�ͬ�����ֽ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7 K2=5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com