
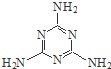
 密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )
密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )| A. | 17:44 | B. | 22:17 | C. | 17:22 | D. | 2:1 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,11.2 LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA | |
| D. | 室温下,将9g铝片投入0.5L18.4mol•L-1的H2SO4中,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
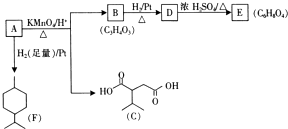
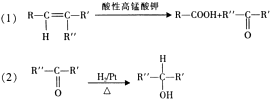
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
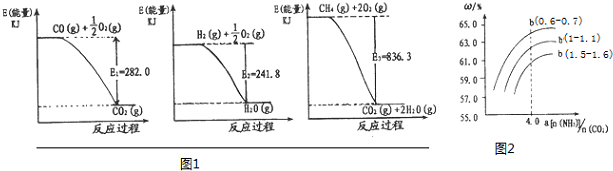
| 时间/S | 0 | 20 | 40 | 60 | 80 |
| N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
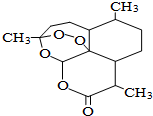 青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )
青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )| A. | 青蒿素能与热的NaOH溶液反应 | B. | 青蒿素的分子式为C15H21O5 | ||
| C. | 青蒿素分子结构中只含有极性键 | D. | 青蒿素能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
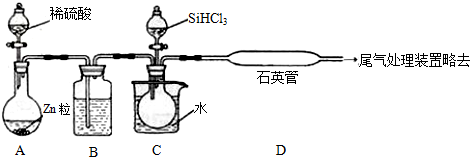
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液腐蚀铜印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| C. | 明矾溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.05molH2O2中含有的阴离子数为0.05NA | |
| C. | 3mol单质Fe与足量水蒸气在一定条件下反应失去9NA 个电子 | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com