
| A. | 氢氧化钠溶液 | B. | 通入二氧化碳 | C. | 氢氧化钙溶液 | D. | 盐酸 |
分析 A.氢氧化钠能与碳酸氢根反应生成碳酸根;
B.CO2与碳酸根反应生成碳酸氢根;
C.Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH;
D.HCl+NaHCO3=NaCl+H2O+CO2↑,所以通入氯化氢气体后,碳酸氢根离子浓度减小.
解答 解:A.氢氧化钠能与碳酸氢根反应生成碳酸根,碳酸氢根浓度减小,故A错误;
B.CO2与碳酸根反应生成碳酸氢根,c(HCO3-)增大,故B错误;
C.Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH,所以加入饱和石灰水溶液后,碳酸氢根离子转化为碳酸钙沉淀,所以碳酸氢根离子浓度、碳酸根离子浓度都减小,溶液由弱碱性变为强碱性,所以氢离子浓度也减小,pH增大,故C正确;
D.HCl+NaHCO3=NaCl+H2O+CO2↑,所以通入氯化氢气体后,碳酸氢根离子浓度减小,碳酸根离子浓度减小,故D错误.
故选C.
点评 本题考查了离子间的反应知识,侧重于学生的分析能力的考查,难度不大,易错选项是C,掌握反应原理是解本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸清洗做焰色反应的铂丝 | |
| B. | 金属钠保存在煤油中 | |
| C. | 用丁达尔现象区别溶液与胶体 | |
| D. | 除去粗盐溶液中的Ca2+、SO42-:先加Na2CO3溶液后加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.
某课外小组分别用图所示装置对原电池和电解池原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
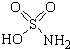 氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )
氨基磺酸(结构如图所示)是一种强酸,工业上用于酸性清洗剂、磺化剂等.加热至60℃时与水反应生成一种盐,该盐的溶液呈强酸性.下列有关氨基磺酸说法正确的是( )| A. | 不溶于水 | B. | 不能清洗铁锈 | ||
| C. | 水溶液中以分子形式大量存在 | D. | 与水反应生成的盐是NH4HSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
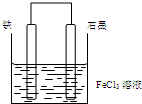
| A. | 电子从石墨棒经外电路流向铁棒 | |
| B. | 总反应为2Fe3++Fe=3 Fe2+ | |
| C. | 石墨电极上发生氧化反应 | |
| D. | 铁电极逐渐变细,石墨电极逐渐变粗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaSiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| B. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| C. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| D. | 氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com