
【题目】为验证铜与稀硝酸反应的还原产物是NO而不是NO2。某同学设计了如图所示的装置,下列叙述错误的是( )

A.应先打开活塞,再从U形管右侧加入稀硝酸
B.加入的稀硝酸应充满U形管左侧
C.反应停止后打开活塞,气体变成红棕色
D.关闭活塞后铜丝会全部溶解
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
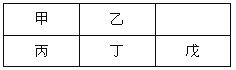
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,H2R及其钠盐的混合溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。下列叙述错误的是
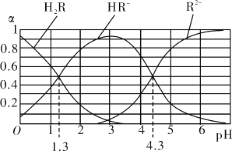
A. 由图可知:H2R的pKa1=1.3(已知:pKa= -lgKa)
B. 在pH=4.3的溶液中:3c(R2-) > c(Na+)
C. 0.2mol/L H2R溶液与0.3mol/L NaOH溶液等体积混合后的溶液中pH=4.3
D. 在pH=3的溶液中存在 ![]() =10-3
=10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2 (g)+B2 (g)=2AB (g)的能量变化如图所示,下列叙述正确的是
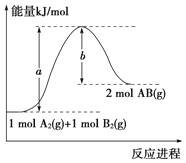
A. 该反应每生成2分子AB吸收(a-b)kJ能量
B. 该反应中反应物的总能量高于生成物的总能量
C. 该反应的反应热ΔH=+(a-b) kJ·mol-1
D. 断裂1molA-A键和1molB-B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 硅晶体和二氧化硅晶体中都含共价键
B. 冰和干冰熔化时克服的作用力均为分子间作用力
C. 硫晶体和硫酸钠晶体均属于离子晶体
D. 氯气和四氯化碳分子中每个原子的最外电子层都形成了具有8个电子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是

A. b点对应的Ksp等于c点对应的Ksp
B. 采取蒸发溶剂的方法可以使溶液从a点变到b点
C. 该温度下,Ag2SO4的Ksp=1.6×10-5
D. 0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
![]()
写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
③计算B点时该反应的压强平衡常数Kp(B)=________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加KSCN溶液,再滴加____,该过程的现象为__________________________________________________。
(2)步骤②加入过量H2O2的目的是___________________________________。
(3)步骤③中反应的离子方程式是__________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、____________、灼烧、______、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应总伴随着能量的变化,下列叙述中正确的是
A.图1表示25min内,Y的平均速率为0.016molL-1min-1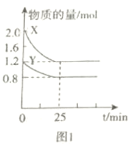
B.图2可表示碳与二氧化碳的反应能量变化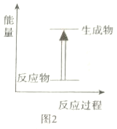
C.图3表示在铁金属内部电子流向碳一侧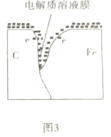
D.图4表示反应2NO+2CO=N2+2CO2中NO和CO转化率为2:1时,反应达平衡状态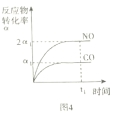
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com