
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
② CaSO4(s)+CO(g)CaO(s)+CO2(g) +SO2(g)
ΔH2=+210.5 kJ·mol-1
③ CO(g)1/2C(s)+1/2CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)
(2)[2014·全国新课标Ⅰ,28(2)]已知:
甲醇脱水反应
2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OH(g)===CH3OCH3(g) ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。
(3)[2014·四川理综,11(3)]已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是__________________________________________________________。
解析 (1)根据盖斯定律,可知①×4+②+③×2得ΔH=4ΔH1+ΔH2+2ΔH3。
(2)2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1 ①
2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1 ②
C2H5OH(g)===CH3OCH3(g) ΔH3=+50.7 kJ·mol-1 ③
根据盖斯定律,由①-②-③得:
C2H4(g)+H2O(g)===C2H5OH(g) ΔH=-45.5 kJ·mol-1。
(3)将题中三个热化学方程式由上到下依次编号为①、②、③;
根据盖斯定律可知,③-①-②得
MnO2(s)+SO2(g)===MnSO4(s)
ΔH=-1 065 kJ·mol-1+520 kJ·mol-1+297 kJ·mol-1=-248 kJ·mol-1
答案 (1)4ΔH1+ΔH2+2ΔH3
(2)-45.5
(3)MnO2(s)+SO2(g)===MnSO4(s) ΔH=-248 kJ·mol-1


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。
电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe做电极的原因为_____________________________________________。
(2)在阴极附近溶液pH升高的原因是 (用电极反应解释) __________________。
溶液中同时生成的沉淀还有___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是_______________________________________________________;
纯碱溶液呈碱性的原因是(用离子方程式表示)___________________________。
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:
__________________________________________________________________。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是
_____________。
A.甲学生:在醋酸钠溶液中滴入2滴酚酞溶液,加热后红色加深,说明盐类水解是吸热反应
B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应
C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
B项中和反应本身是放热反应,C项是因为NH4NO3溶于水吸热,D项是因为NH4Cl抑制NH3·H2O 的电离而使pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
现有X、Y、Z、W四种短周期主族元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z的原子序数之和为40,最外层电子数之和为10,下列说法正确的是( )
A.Y的最高价氧化物对应的水化物一定是强碱
B.Z一定位于ⅦA族
C.若X、Y、W形成的化合物为XYW2,则其水溶液显碱性
D.X与足量的W反应生成的化合物为X2W
查看答案和解析>>
科目:高中化学 来源: 题型:
LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1;
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1。
则LiH在O2中燃烧的热化学方程式为( )
A.2LiH(s)+O2(g)===Li2O(s)+H2O(l) ΔH=-702 kJ·mol-1
B.2LiH(s)+O2(g)===Li2O(s)+H2O(l) ΔH=-1 950 kJ·mol-1
C.2LiH(s)+O2(g)===Li2O(s)+H2O(l) ΔH=-1 586 kJ·mol-1
D.2LiH(s)+O2(g)===Li2O(s)+H2O(g) ΔH=-988 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/ (mol·L-1) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
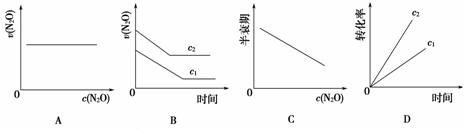
查看答案和解析>>
科目:高中化学 来源: 题型:
若以ω1和ω2分别表示浓度为amol•L﹣1和bmol•L﹣1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
|
| A. | 2ω1=ω2 | B. | 2ω2=ω1 | C. | ω2>2ω1 | D. | ω1<ω2<2ω1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列叙述回答本题.立方烷(C8H8)、棱晶烷(C6H6)是近年来运用有机合成的方法制备的具有如图1所示立方体结构的环状有机物.萜类化合物是广泛存在于动、植物体内的一类有机物(例如盆烯,月桂烯,柠檬烯).对上述有机物下列说法正确的是( )
①盆烯、月桂烯、柠檬烯都能使溴水褪色
②棱晶烷、盆烯与苯互为同分异构体
③月桂烯、柠檬烯互为同分异构体
④立方烷、棱晶烷是环烷烃的同系物.
|
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com