
【题目】实验室欲配制480mL0.5mol·L-1的CuSO4溶液,据此回答下列问题:
(1)需称量胆矾CuSO4.5H2O__g。
(2)在配制的过程中一定不需要使用到的仪器是(填写代号)__,还缺少的仪器有__、__。
A.烧杯 B.药匙 C.玻璃棒 D.1000mL容量瓶 E.锥形瓶 F.胶头滴管
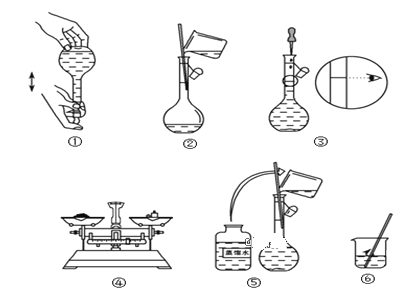
(3)如图所示的实验操作的先后顺序为__。
(4)从配制好的CuSO4溶液中取出10mL,将这10mL的CuSO4溶液稀释至100mL,稀释后CuSO4溶液的浓度变为__mol·L-1。
(5)下列的实验操作可能导致配制的溶液浓度偏低的是__。
A.容量瓶内原来存有少量的水
B.定容时液面超过刻度线,用胶头滴管吸出
C.称量所需CuSO4.5H2O的质量时,物品与砝码的位置放反了(1g以下用游码)
D.定容时俯视刻度线
【答案】62.5g DE 500mL容量瓶 托盘天平 ④⑥②⑤③① 0.05mol/L BC
【解析】
配制溶液的一般步骤为计算,称量(或量取),溶解(或稀释),冷却室温,移液,洗涤,定容,颠倒摇匀,装试剂瓶贴标签。稀释前后溶液中溶质的物质的量不变,稀释定律为c(浓)V(浓)=c(稀)V(稀)。根据浓度定义公式c=![]() 可知,若使n偏小,或者V偏大,会使配制结果偏小。
可知,若使n偏小,或者V偏大,会使配制结果偏小。
(2)在配制的过程中需要使用到的仪器有天平(带砝码),药匙,量筒,胶头滴管,烧杯,玻璃棒,500mL容量瓶。
(1)配制480mL0.5molL-1的硫酸铜溶液,应选择500mL容量瓶,实际配制500mL溶液,依据m=cVM计算需要溶质的质量,即需要溶质CuSO45H2O的质量为: 0.5mol/L×0.5L×250g/mol=62.5g,故答案为:62.5;
(2)在配制的过程中需要使用到的仪器有天平(带砝码),药匙,量筒,胶头滴管,烧杯,玻璃棒,500mL容量瓶,可知一定不需要使用到的仪器是1000mL容量瓶、锥形瓶,还缺少的仪器有500mL容量瓶、托盘天平,故答案为:DE, 500mL容量瓶,托盘天平;
(3)根据配制溶液的一般步骤结合图示可知,④称量,⑥溶解,②移液,⑤③定容①颠倒摇匀,所以实验操作的先后顺序为④⑥②⑤③①,故答案为:④⑥②⑤③①;
(4)根据稀释定律,稀释后硫酸铜的浓度为c=![]() =0.05mol/L,故答案为:0.05mol/L;
=0.05mol/L,故答案为:0.05mol/L;
(5)A.容量瓶内原来存有少量的水,不会影响n,V的大小,所以对所配溶液浓度无影响,故A错误;
B.定容时液面超过刻度线,用胶头滴管吸出,则会导致溶质的物质的量n减小,所以导致所配溶液浓度偏小,故B正确;
C.称量所需CuSO4.5H2O的质量时,物品与砝码的位置放反了(1g以下用游码),则会导致溶质的物质的量n偏小,所以导致所配溶液浓度偏小,故C正确;
D.定容时俯视刻度线, 则会导致溶液的体积V偏小,所以导致所配溶液浓度偏大,故D错误;
综上所述,答案为:BC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用NH3·H2O溶液做导电性实验,灯泡很暗,说明NH3·H2O是弱电解质
B.等体积的pH都为2的酸HA和HB分别与足量的铁粉反应,HA放出的H2多,说明HA酸性强
C.c=0.1 mol·L-1的CH3COOH溶液和c=0.1 mol·L-1的HCl溶液中,前者的pH大
D.常温下,pH=5的CH3COOH溶液和pH=4的HCl溶液中,c(CH3COO-)/c(Cl-)=1/10
查看答案和解析>>
科目:高中化学 来源: 题型:
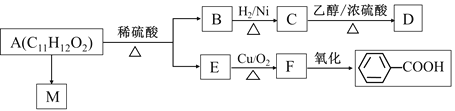
【题目】已知A为某种聚甲基丙烯酸酯纤维(M)的单体,其转化关系如图:
回答下列问题:
(1)B中含氧官能团的结构简式为_______;C用系统命名法命名为___________________。
(2)反应A→M的反应类型为___________;M的结构简式为___________________________。
(3)反应C→D的化学方程式为_______________________________。F与银氨溶液反应的化学方程式为________________________。
(4)关于E的下列说法正确的是________________(填写序号)。
①分子中所有碳原子都在同一平面上;
②能与H2反应;
③能与NaOH的醇溶液反应;
④能与溴水反应。
(5)写出满足下列条件的A的同分异构体的结构简式:______________________。
①与A具有相同的官能团;
②水解产物之一(相对分子质量为108)遇FeCl3溶液显紫色;
③核磁共振氢谱有5种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物![]() 如图所示
如图所示![]() ,发生反应:
,发生反应:![]() 保持温度不变,测得平衡时的有关数据如下:
保持温度不变,测得平衡时的有关数据如下:
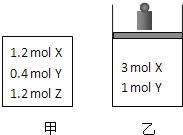
恒容容器甲 | 恒压容器乙 | |
Y的物质的量 |
|
|
Z的体积分数 |
|
|
下列说法正确的是![]()
A.平衡时容器乙的容积一定比反应前小
B.![]()
C.![]()
D.平衡时容器甲的压强一定比反应前大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某固体化合物X(仅含四种元素)的组成和性质,设计并完成如下实验。请回答:
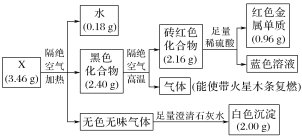
(1)蓝色溶液中的金属阳离子是________。
(2)黑色化合物→砖红色化合物的化学方程式是________________________。
(3)X的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.已知氢气有多种制取方法:
①活泼金属![]() 如钠、钾
如钠、钾![]() 直接跟水反应;
直接跟水反应;
②金属![]() 如锌或铁或铝
如锌或铁或铝![]() 跟稀盐酸或稀硫酸反应;
跟稀盐酸或稀硫酸反应;
③电解水制氢气;
④由煤或焦炭跟水反应制取氢气:![]()
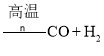 ;
;
⑤由天然气或重油制取氢气:![]()

![]() ;
;
(1)请你再补充一种制取氢气的方法,写出该反应的化学方程式 ______ .
(2)比较方法①和⑤: ______ g金属钠跟水反应与标准状况下![]()
![]() 跟水反应产生氢气的量相等.
跟水反应产生氢气的量相等.
(3)在甲、乙、丙3个容积均为2L的密闭容器中,于相同的温度下、使用相同的催化剂分别进行如下反应: 3H2(g)+N2(g) ![]() 2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 |
|
|
|
达到平衡的时间 |
| 5 | 8 |
| c |
| c |
|
|
|
|
混合气体密度 |
|
|
|
①分析表数据,下列关系正确的是 ______ ![]() 填写序号字母
填写序号字母![]() .
.
A.![]()
![]()
![]()
②在该温度下该反应的平衡常数![]() ______
______ ![]() 用含
用含![]() 的代数式表示
的代数式表示![]() .
.
(4)已知:![]() ;
;![]()
![]() ;
;![]()
则甲烷和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式为 ______ .
的热化学方程式为 ______ .
(5)如图所示装置工作时均与![]() 有关.
有关.
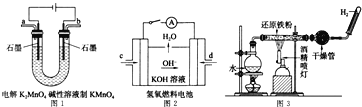
①图1所示装置中阳极的电极反应式为 ______ .
②图2所示装置中,通入![]() 的管口是 ______
的管口是 ______ ![]() 选填字母代号
选填字母代号![]() .
.
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和![]() 该结论 ______
该结论 ______ ![]() 填“严密”或“不严密”
填“严密”或“不严密”![]() ,你的理由是 ______
,你的理由是 ______ ![]() 用离子方程式表示
用离子方程式表示![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:![]() 三氯化氮
三氯化氮![]() 是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量
是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量![]() ,而在阴极区与生成的氯气反应产生少量
,而在阴极区与生成的氯气反应产生少量![]() ,该反应的化学方程式为______。
,该反应的化学方程式为______。![]() 一定条件下,不同物质的量的
一定条件下,不同物质的量的![]() 与不同体积的
与不同体积的![]() 溶液充分反应放出的热量如下表所示:
溶液充分反应放出的热量如下表所示:
反应序号 | n | V | 放出的热量 |
1 |
|
| A |
2 |
|
| b |
该条件![]() 与NaOH 溶液反应生成
与NaOH 溶液反应生成![]() 的热化学反应方程式为______。
的热化学反应方程式为______。![]() 利用CO可以将NO转化为无害的
利用CO可以将NO转化为无害的 ,其反应为:
,其反应为:![]() ,向容积均为1L的甲,乙两个恒温
,向容积均为1L的甲,乙两个恒温![]() 温度分别为
温度分别为![]() 、
、![]() 容器中分别加入
容器中分别加入![]() 和
和![]() ,测得各容器中
,测得各容器中![]() 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
| 0 | 40 | 80 | 120 | 160 |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 甲容器中,
甲容器中,![]() 内用NO的浓度变化表示的反应速率
内用NO的浓度变化表示的反应速率![]() ______。
______。![]() 该反应的
该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______
甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。![]() 常温下,在
常温下,在![]() 溶液中,反应
溶液中,反应![]() 的平衡常数
的平衡常数![]() ______。
______。![]() 已知常温下,
已知常温下,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]()
![]() 在酸性电解质溶液中,以惰性材料作电极,将
在酸性电解质溶液中,以惰性材料作电极,将![]() 转化为丙烯的原理如图所示
转化为丙烯的原理如图所示
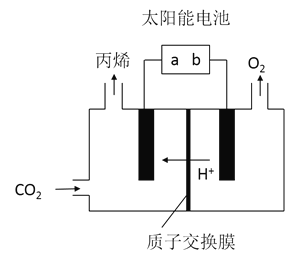
![]() 太阳能电池的负极是______
太阳能电池的负极是______![]() 填“a”或“b”
填“a”或“b”![]()
![]() 生成丙烯的电极反应式是______。
生成丙烯的电极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是
A. Na2S 溶液中 c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
B. Na2CO3溶液中:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
C. 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,溶液中离子浓度的大小顺序:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. pH=4的0.1molL﹣1NaHC2O4溶液中c(H C2O4﹣)>c(H+)>c(H2C2O4)>c(C2O42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
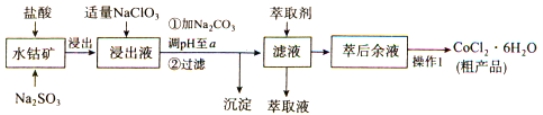
已知:①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
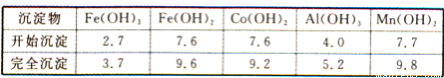
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式:_______________。
(2)若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式:_______________。
(3)“操作1”中包含3个基本实验操作,它们依次是_____________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是_____________。
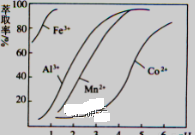
(4)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是____________,其使用的最佳pH范围是______。
A 2.0~2.5 B 3.0~3.5 C 4.0~4.5 D 5.0~5.5
(注:横坐标依次为1-6;单位:PH)
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是__________。(答一条即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com