
| m |
| M |
| V |
| Vm |
| N |
| NA |


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验 | 用CCl4萃取 溴水中的溴 | 从NaCl与I2的混合物中回收I2 | 制备与收集二氧化硫 | 制备乙酸丁酯 |
| 装置 |  |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加适量6mol?L-1HCl溶液 |
| B、加数滴CuCl2溶液 |
| C、加适量醋酸钠固体 |
| D、加适量NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所得分散系极不稳定 |
| B、具有丁达尔效应 |
| C、不能透过滤纸 |
| D、以上性质都不具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol?L-1醋酸溶液 |
| B、0.02mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| C、0.03mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| D、pH=2的盐酸与pH=12NaOH溶液等体积混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
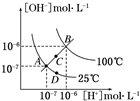
| A、图中四点KW间的关系:A=D<C<B |
| B、若从A点到C点,可采用温度不变在水中加少量CH3COONa固体 |
| C、若从A点到D点,可采用温度不变在水中加少量酸 |
| D、若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙醇与浓氢溴酸反应:CH3CH2OH+HBr
| |||
B、溴乙烷与氢氧化钠溶液共热:CH3CH2HBr+NaOH
| |||
C、苯酚钠中通入二氧化碳2 +CO2+H2O→ +CO2+H2O→ +Na2CO3 +Na2CO3 | |||
D、蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:


 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com