
| A. | H2、I2、HI的浓度相等 | |
| B. | 混合气体密度恒定不变 | |
| C. | 混合气体的质量不再改变 | |
| D. | 1个I-I键断裂的同时,有2个H-I键断裂 |
分析 可逆反应H2(g)+I2(g)?2HI(g)达到平衡状态时,正反应速率与逆反应速率相等,各组分的浓度、百分含量不再发生变化,注意该反应为气体体积不变的反应,气体总物质的量始终不变,据此进行解答.
解答 解:A.H2、I2、HI的浓度相等时,无法判断各组分的浓度是否不再变化,则无法判断是否达到平衡状态,故A错误;
B.该反应前后都是气体,气体总质量不变,若容器容积不变,则反应过程中气体的密度始终不变,不能根据密度判断平衡状态,故B错误;
C.反应前后都是气体,所以反应过程中气体的总质量始终不变,不能根据混合气体质量判断平衡状态,故C错误;
D.1个I-I键断裂的同时,有2个H-I键断裂,表示的是正逆反应,其满足计量数关系,说明正逆反应速率相等,该反应的达到平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意熟练掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题

| A. | a为电池的负极 | |
| B. | 电池充电时a极反应为:Li1-xMn2O4+xe-+xLi+═LiMn2O4 | |
| C. | 充电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中SO42-从a向b迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol任何物质的体积都约为22.4 L | |
| B. | 标准状况下,18g H2O所占的体积约为22.4 L | |
| C. | 标准状况下,1mol O2和N2的混合气体的体积约为是22.4L | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: | B. | NH3的电子式: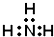 | ||
| C. | Ca2+的结构示意图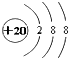 | D. | 次氯酸的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.根据你所学的知识回答下列问题:
蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.根据你所学的知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75:2);②在碳存在下,X与N2反应生成AlN.请回答:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75:2);②在碳存在下,X与N2反应生成AlN.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com