
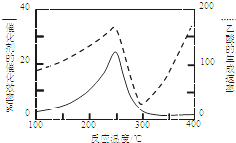
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.分析 (1)根据盖斯定律结合已知热化学方程式来解答;
(2)①根据温度对催化剂活性的影响;
②根据外界条件对化学平衡的影响,平衡正向移动,反应物转化率增大;
③先将Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性;
(3)①根据化合价升降以及电子转移计算反应生成1molFe3O4电子转移的量;
②根据原电池原理,CO2在正极发生还原反应转化为甲烷,注意电解质溶液为碱性.
解答 解:(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=akJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=bkJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=ckJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=(a+2b?2c)kJ•mol-1.
故答案为:a+2b?2c;
(2)①由于催化剂的催化效率受温度影响大,所以250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
②该反应是体积减小的可逆反应,所以为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强或增大CO2的浓度,
故答案为:增大反应压强或增大CO2的浓度;
③硝酸是氧化性酸,稀硝酸的还原产物是NO,则根据电子得失守恒和原子守恒可知Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16 H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O;
(3)①根据方程式6FeO+CO2=2Fe3O4+C可知反应中每生成1molFe3O4,消耗0.5molCO2.其中碳元素的化合价从+4价降低到0价,则转移电子的物质的量为2mol,
故答案为:2;
②铜是活性电极,如果在铜电极上CO2可转化为CH4,这说明铜电极是阴极,则另一电极石墨连接电源的正极,该电极是阳极,溶液中的氢氧根失去电子转化为氧气,则该电解反应的化学方程式为CO2+2H2O$\frac{\underline{\;电解\;}}{\;}$CH4+2O2,
故答案为:正;CO2+2H2O$\frac{\underline{\;电解\;}}{\;}$CH4+2O2.
点评 本题主要考查盖斯定律、影响化学反应速率和平衡的因素以及原电池原理的运用等知识,难度不大,根据所学知识即可完成.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | A、H、J的离子半径由大到小顺序是H>J>A | |
| C. | HE3中H与E之间以离子键结合 | |
| D. | A单质能从B的氢化物中置换出B单质来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3分子中氮原子的轨道杂化方式为sp3杂化 | |
| B. | [Cu(NH3)4]2+中,NH3分子是配体 | |
| C. | NH4+与PH4+、CH4、BH4-互为等电子体 | |
| D. | 相同压强下,NH3沸点比PH3的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强恒定不变 | |
| B. | 混合气体的密度不再改变 | |
| C. | H2、I2、HI的浓度相等 | |
| D. | I2在混合气体中的体积分数不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物溶于水,水溶液一定显酸性 | D. | 其最高价氧化物对应水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 由共价键形成的物质一定是共价化合物 | |
| D. | 非金属原子间形成的化学键一定是共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
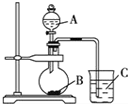 某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.
某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com